在上一篇文章中,我们会发现在5配位和6配位时,有时是外层的d轨道参与杂化,有时是内层的d轨道参与杂化。
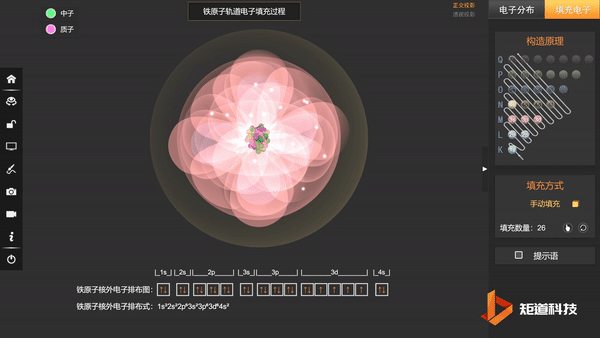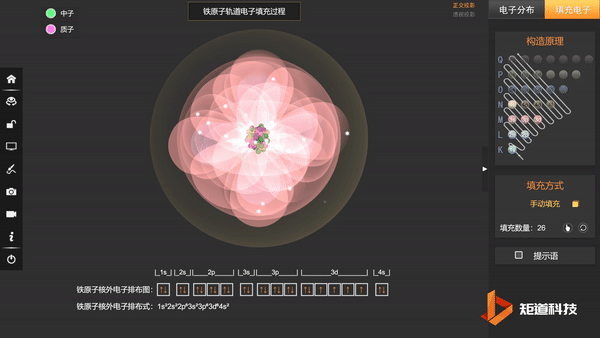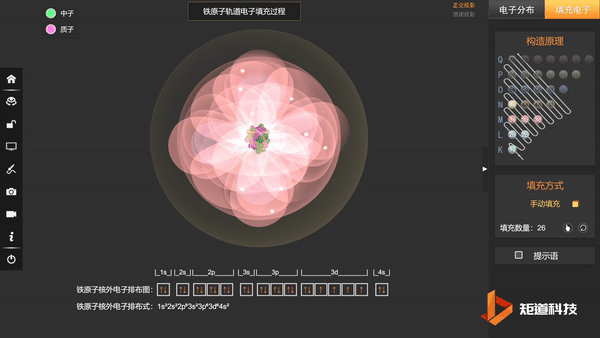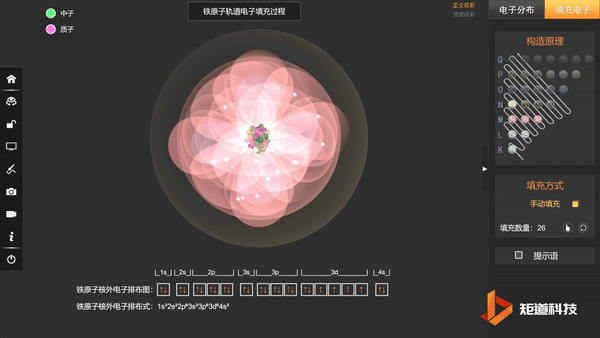
Fe原子的核外电子排布
例如,Fe²⁺与CN⁻形成[Fe(CN)₆]⁴⁻时,CN⁻对电子的排斥力很强,可以将Fe²⁺中原本分散在3d轨道的单电子挤入3个3d轨道中,空出2个3d轨道,并与1个4s轨道、3个4p轨道重排发生d²sp³杂化。6个d²sp³杂化轨道与6个CN⁻提供的孤电子对形成配位键。
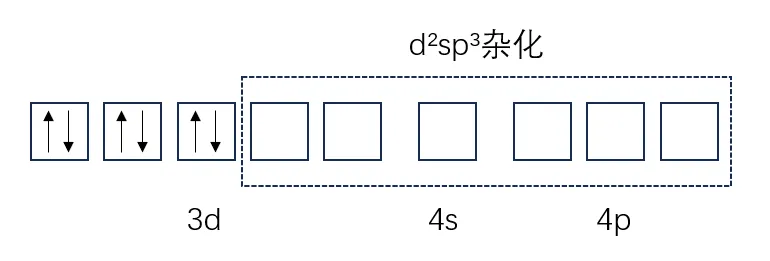
[Fe(CN)₆]⁴⁻中的Fe²⁺没有不成对电子
而[FeF₆]⁴⁻虽然和[Fe(CN)₆]⁴⁻一样都是正八面体构型的配离子,但是在[FeF₆]⁴⁻的Fe²⁺中,5个3d轨道都有电子,因此会由1个4s轨道、3个4p轨道和2个4d轨道杂化,生成的6个sp³d²杂化轨道与6个F⁻提供的孤电子对形成配位键。
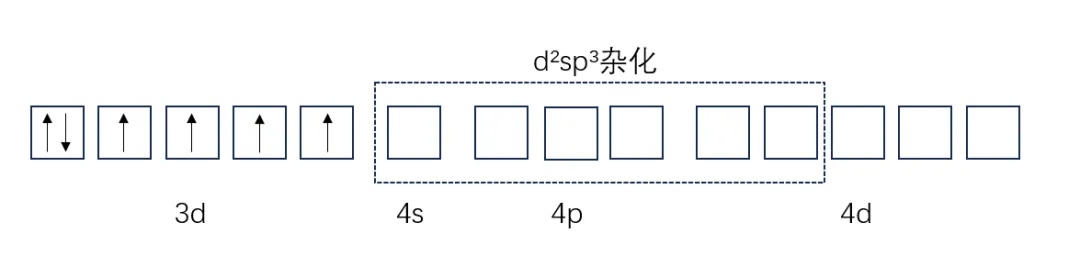
[FeF₆]⁴⁻中的Fe²⁺有4个不成对电子
这两种配位键分别叫做内轨配键和外轨配键。中心原子或离子以外层的ns、np和nd轨道杂化而形成杂化轨道,并与配体形成配位键称为外轨配键,以外轨配键所形成的配合物叫外轨配合物。[FeF₆]⁴⁻就是外轨配合物。
反之,中心原子或离子以部分次外层(n-1)d轨道参与杂化而形成的杂化轨道所形成的配位键叫内轨配键,以内轨配键所形成的配合物叫内轨配合物。[Fe(CN)₆]⁴⁻就是内轨配合物。
矩道化学VR/3D融合创新实验室“物质结构与性质”模块,基于一线教学实践,以学科素养为指导,以开放性、探究性、学科性为主要目标,提供了原子、分子结构与性质、晶体结构与性质等丰富的VR教育资源超90个。

可自由操作互动性强,兼具常态化和新型教学互动,便于老师多样化教学,灵活掌控教学节奏。微观结构与原理可视化降低了教学内容抽象性,老师的教学不再停留在表面,可以更容易引导学生进行解释,促使学生反思原有概念模型的局限性,发展学生“证据推理与模型认知”等核心素养。

物质结构与性质模块,将抽象枯燥的微观粒子结构可视化,360度自由探究,形象生动;将晦涩难懂的结构组成规律原理可视化,情境过程化,直观明了;将抽象复杂的微粒性质与计算规律,思维模型外显化、规律情境化,助力高效教与学。每个内容提供了丰富的教学互动,在沉浸式的知识情境中可以灵活开展探究式学习,为教学评一体化背景下的高中化学高效课堂提供了新助力、新方向、新思路!
END
















