矩道化学虚拟现实课堂
01
配位数
配位数指配合物中直接与中心成键的配位原子的个数,注意配位数与配位体个数的不同。例如,[Co(NH₃)₆]Cl₃中配位体个数为6,有6个N原子与Co(III)配位,配位数也是6;但在[Cu(NH₂CH₂COO)₂]中配位体个数为2,但是有2个N原子和2个O原子与Cu(II)配位,配位数是4。
配位数一般为偶数,常见的一般是4和6,配位数为奇数的情况较少。
一般来说,中心的电荷高、半径大,则易于形成配位数高的配合物。氧化数为+1的中心易形成2配位的配合物,如[AgCl₂]⁻;氧化数是+2的中心易形成4配位或6配位的配合物,如[Cu(NH₃)₆]²⁺、[Ni(CN)₄]²⁻等;氧化数为+3的中心则易形成6配位的配合物,如[Co(CN)₆]³⁺、[Fe(CN)₆]³⁻。
中心的电荷高,则中心对配体的吸引力大,可以吸引更多的配体;另一方面,当中心的半径大时,周围才有足够的空间能容纳更多的配体。

更大的中心周围才有更多的空间
02
价键理论-构型
在配合物的结构和成键研究中引入杂化轨道理论,就形成了配合物中的价键理论。
配体中配位原子的孤电子对向中心的空杂化轨道配位形成配位键,配位体之间的排斥作用使配位体之间尽可能远离,保持能量最低,配合物的构型由中心的杂化方式决定。
常见的配位体空间构型与中心轨道杂化方式之间的关系入下表:
配位数 | 中心杂化 方式 | 构型 | 实例 |
2 | sp | 直线形 | [Ag(NH₃)₂]⁺ |
3 | sp² | 三角形 | [Cu(CN)₃]²⁻ |
4 | sp³d² | 四面体形 | [Zn(NH₃)₄]²⁺ |
4 | dsp² | 平面四边形 | [Ni(CN)₄]²⁻ |
5 | sp³d | 三角双锥形 | [Fe(SCN)₅]²⁻ |
5 | dsp³ | 三角双锥形 | [Fe(CO)₅] |
6 | sp³d² | 八面体形 | [Cu(NH₃)₆]²⁺ |
6 | d²sp³ | 八面体形 | [Co(CN)₆]³⁺ |
化学
VR/3D虚拟仿真实验室
矩道化学VR/3D虚拟仿真实验室
矩道高中化学VR/3D虚拟仿真实验室提供优质VR实验资源及数字课程资源600多个,可自由操作互动性强,兼具常态化和新型教学互动,便于教师灵活调控教学节奏,增进师生课堂互动;为学生创造了勤思乐学的沉浸式探究学习情境,助力自学学习能力、学科探究能力以及应用实践能力的综合提升。
以虚补实,弥补实验教学痛点

无机化学反应原理-可视化数据建模
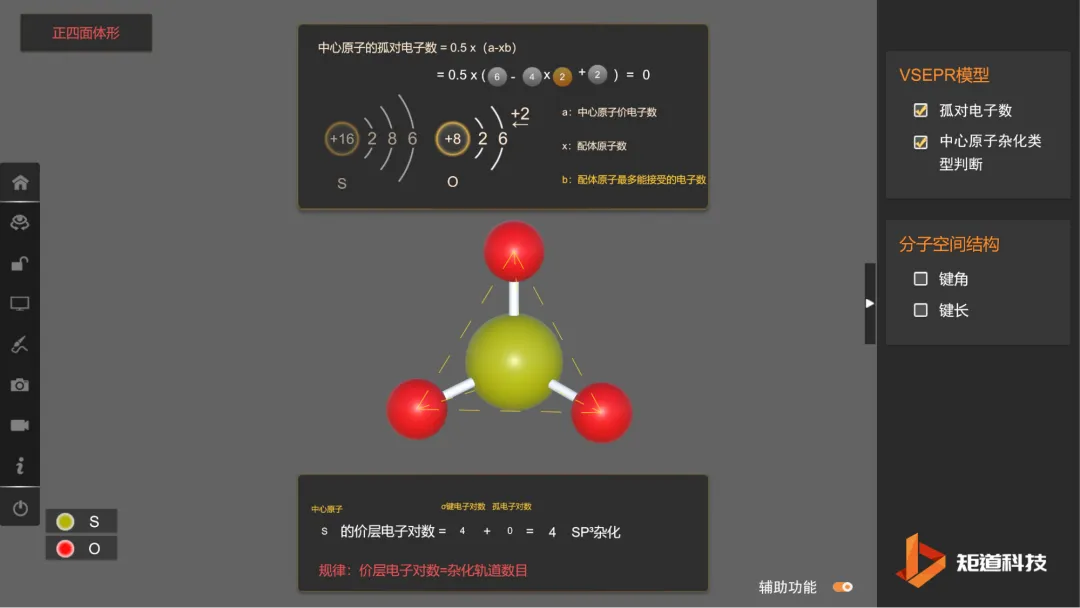
中心原子杂化 - 微观可视化教学情境
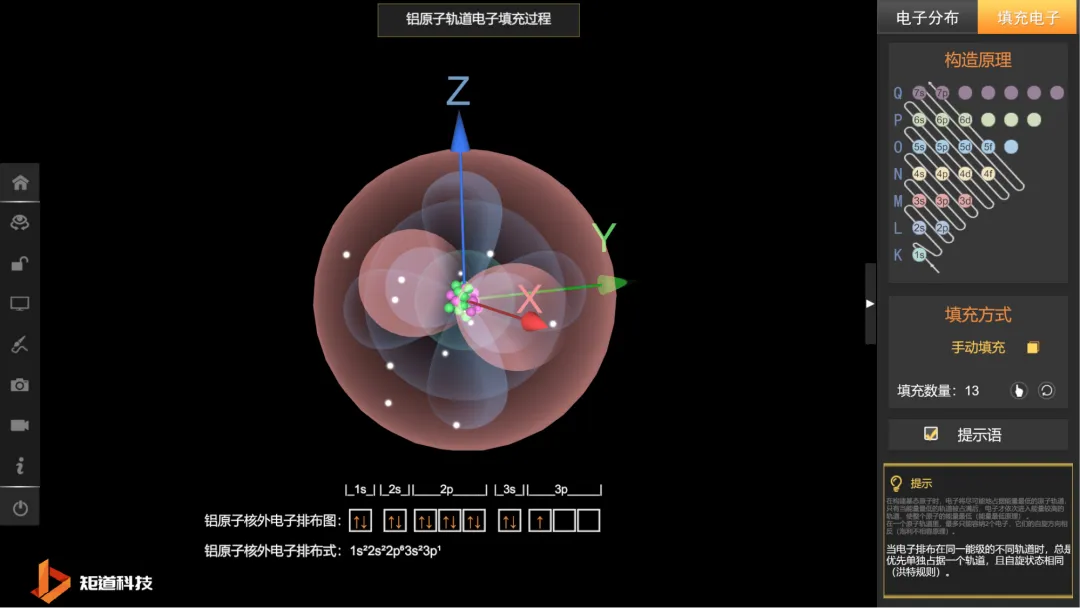
核外电子排布 - 微观可视化教学情境
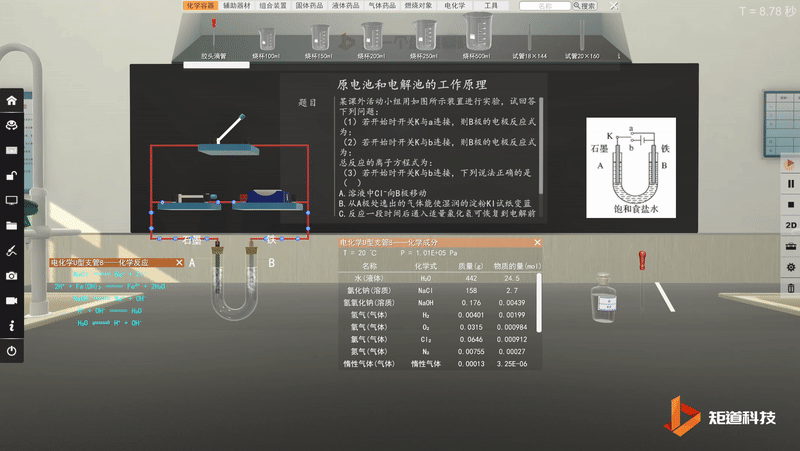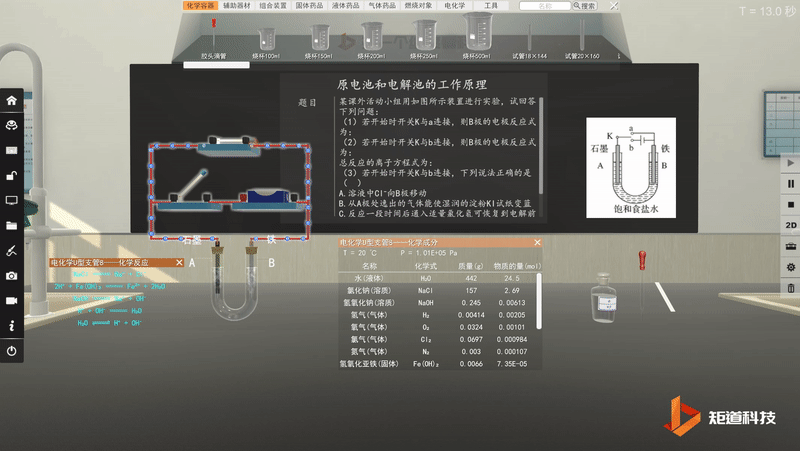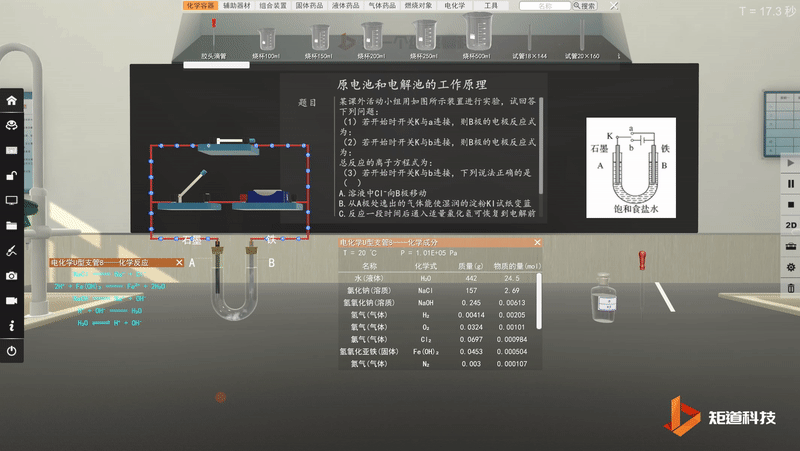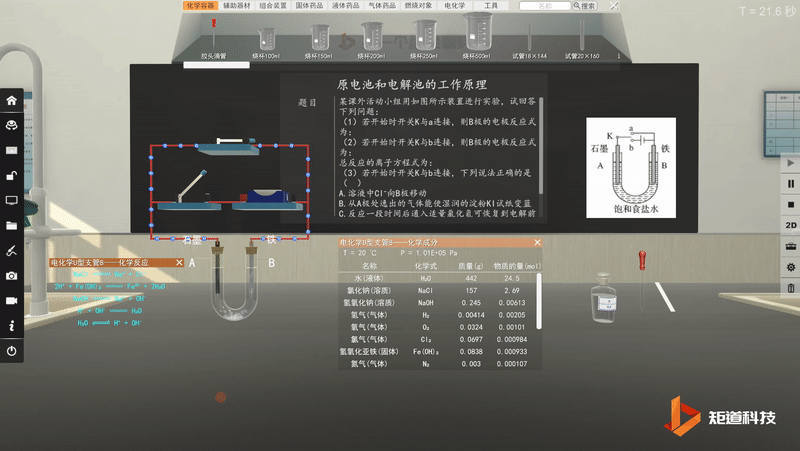
原电池工作原理-可视化思维建模
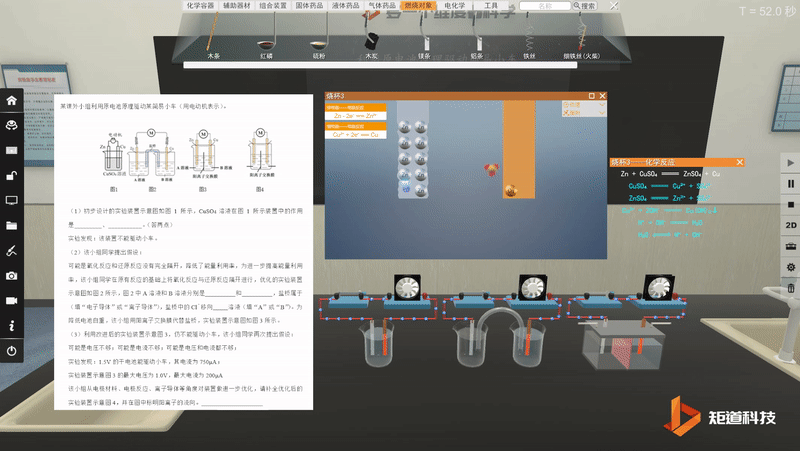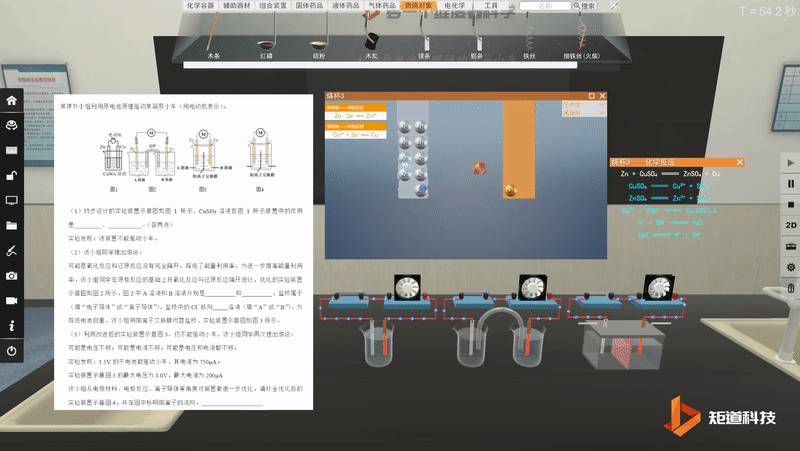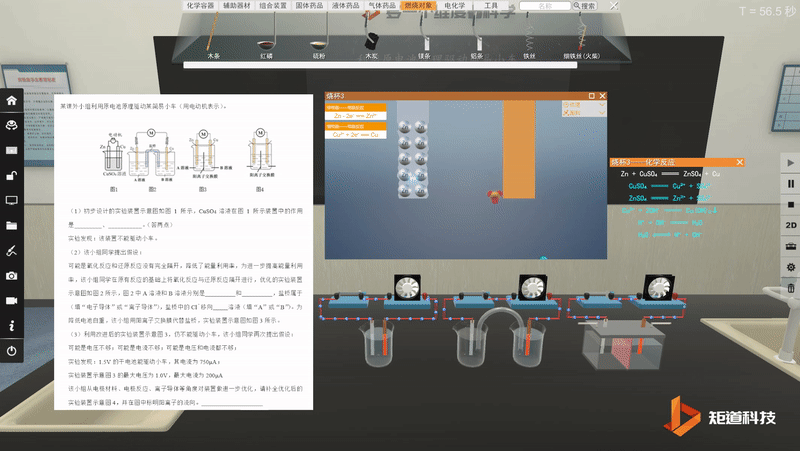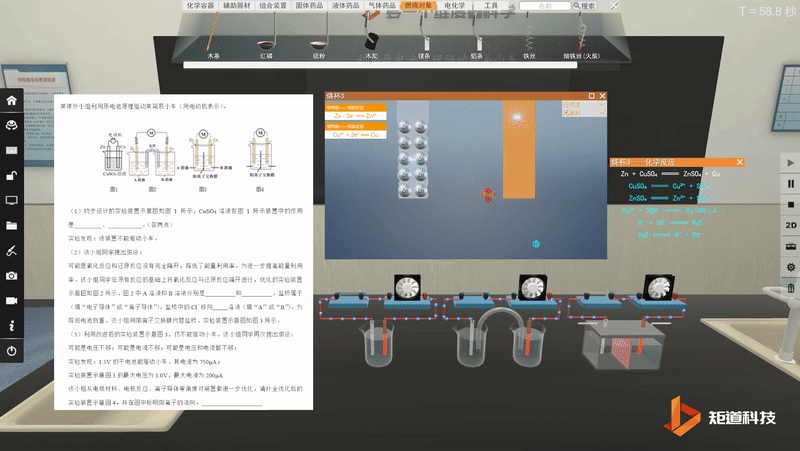
宏观与微观-问题情境的探究与论证
高中化学新课标中指出要聚焦学科核心素养,化学教师需要增进对化学学科的理解,要充分认识教、学、评的目标以及三者不可分离的属性,并贯彻实施教学评一体化,促进学生化学核心素养的形成与全面发展。
END


















