矩道化学虚拟仿真实验室,将常规教学中难以观察的原子的空间微观可视化,抽象晦涩的化学概念原理模型化、过程化,更加高效地辅助老师教学。
分子的空间结构是指其原子在空间的排布,可以用现代实验手段测定。实验证实,属于同一通式的分子或离子,其结构可能相似,也可能完全不同。
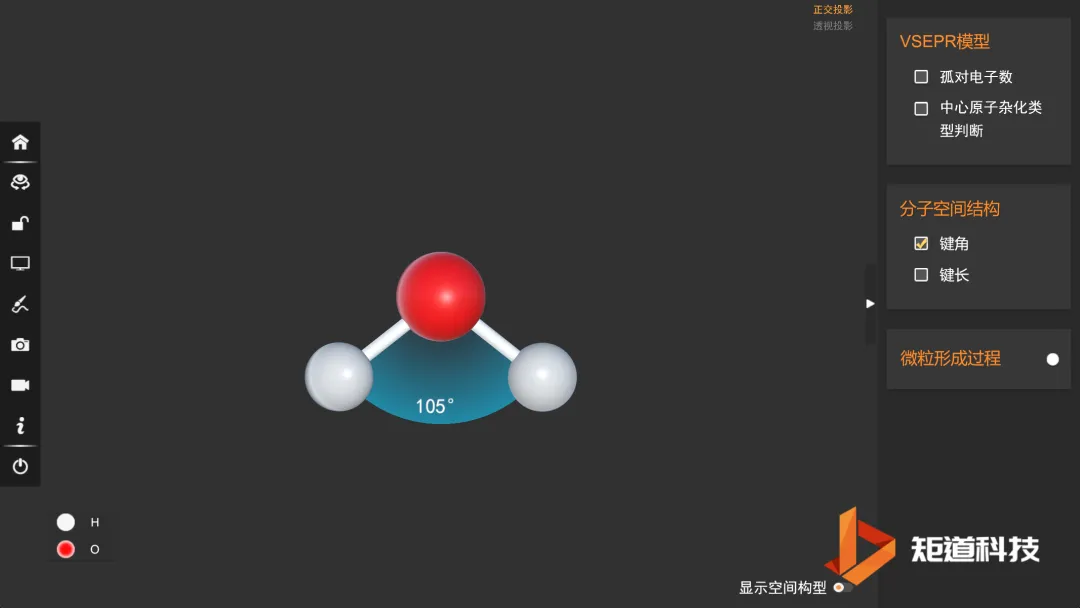
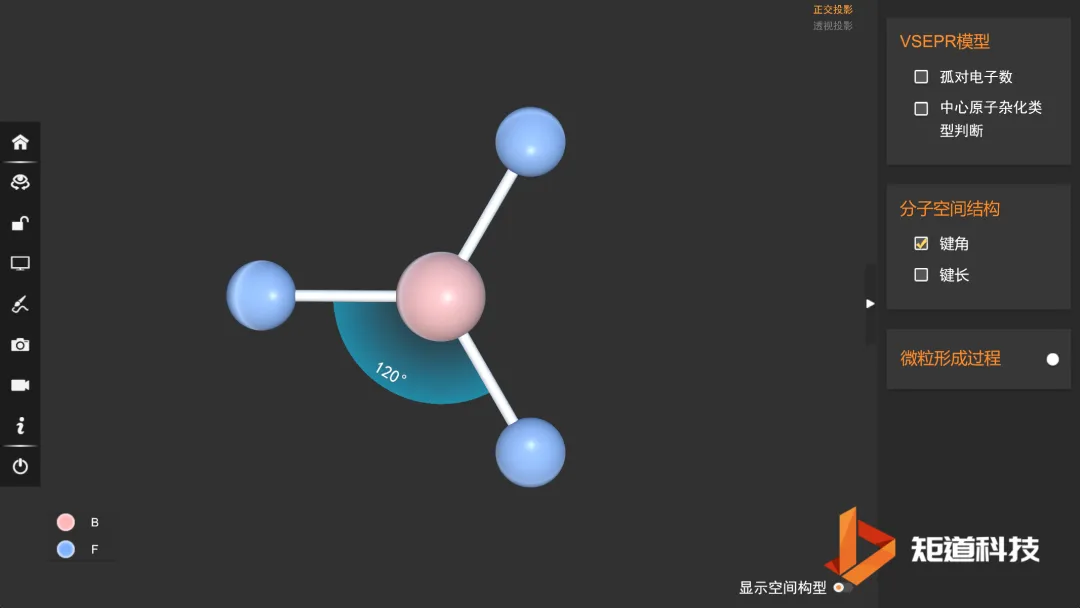
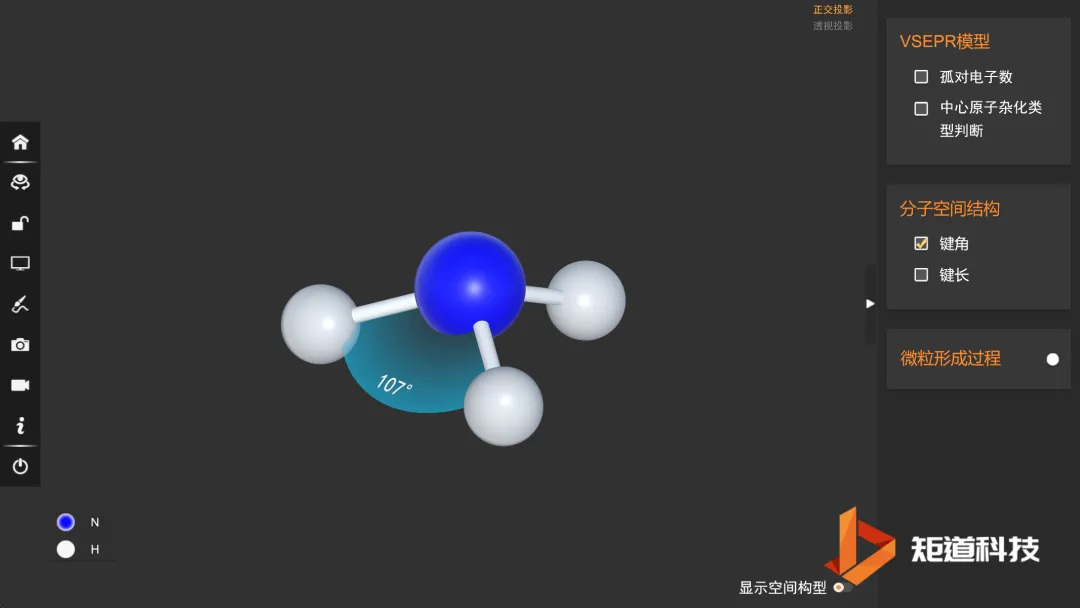
例如,H₂O和H₂S属同一通式H₂A,结构很相似,都是V形分子,仅夹角度数稍有差别;而BF₃和NH₃虽属同一通式AB₃,结构却不同: 前者是平面三角形,后者是三角锥形。
下面借助矩道化学虚拟实验室软件观察不同分子的空间结构。

价层电子对互斥理论(Valence Shell Electron Pair Repulsion,简称为VSEPR),是一个用来预测单个共价分子形态的化学模型。
该理论认为原子周围各个价电子对之间会相互排斥,分子会尽力避免这些排斥来保持稳定。当排斥不能避免时,整个分子倾向于形成排斥最弱的结构。
当中心原子A周围存在n个配位原子X和m个孤对电子对E时,可表示为AXnEm,我们可以采取如下方式预测价层电子对的形状:
(1)孤对电子对的数量m可通过一下式子确定:
m=0.5×(A的族价-X的化合价×X的个数±离子电荷相应的电荷数)
可以理解为:中心原子A的族价等于它的价电子总数,配位原子X的化合价等于中心原子与X成键用去的电子数,离子的电荷相当于中心原子得到或失去的电子。
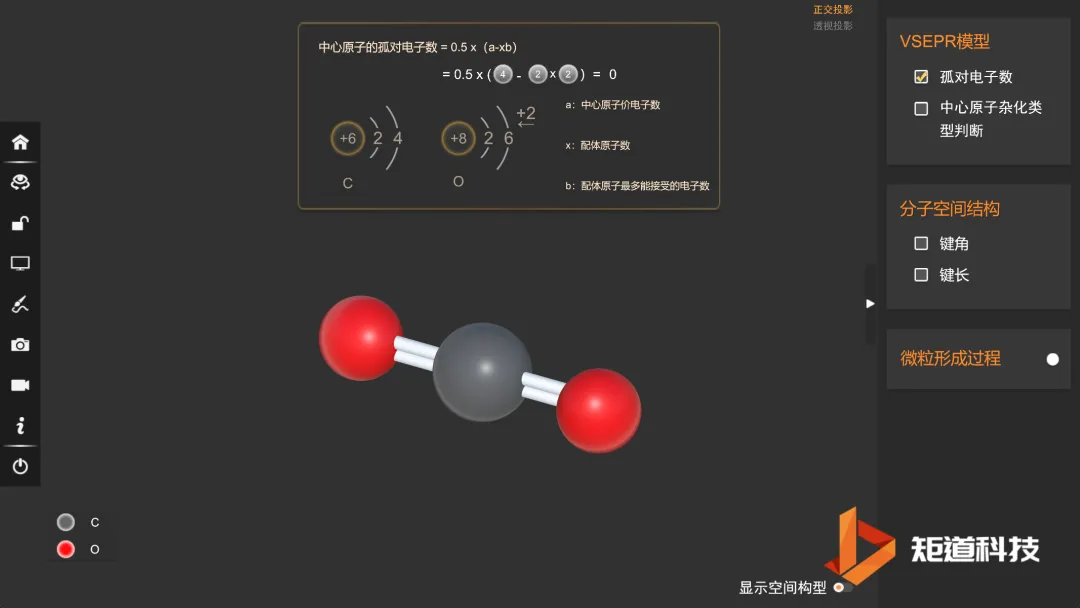
CO₂的孤对电子对数为0
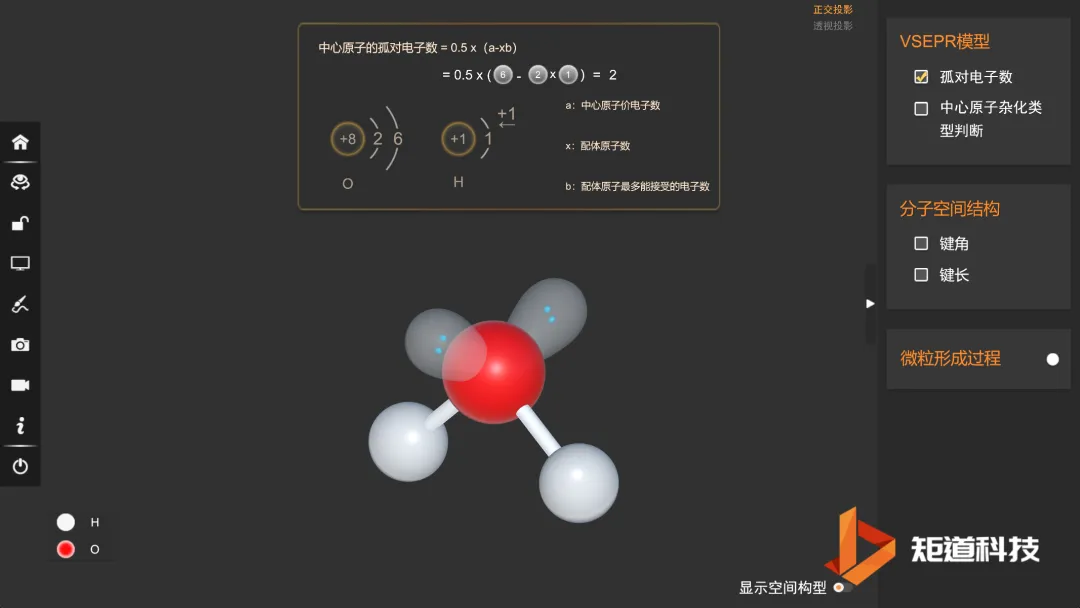
H₂O的孤对电子对数为2
(2)为了使价电子对间斥力最小,可将价电子对看作等距离地排布在同一球面上,形成规则的多面体形式。例如:当n+m=2时,取直线形;
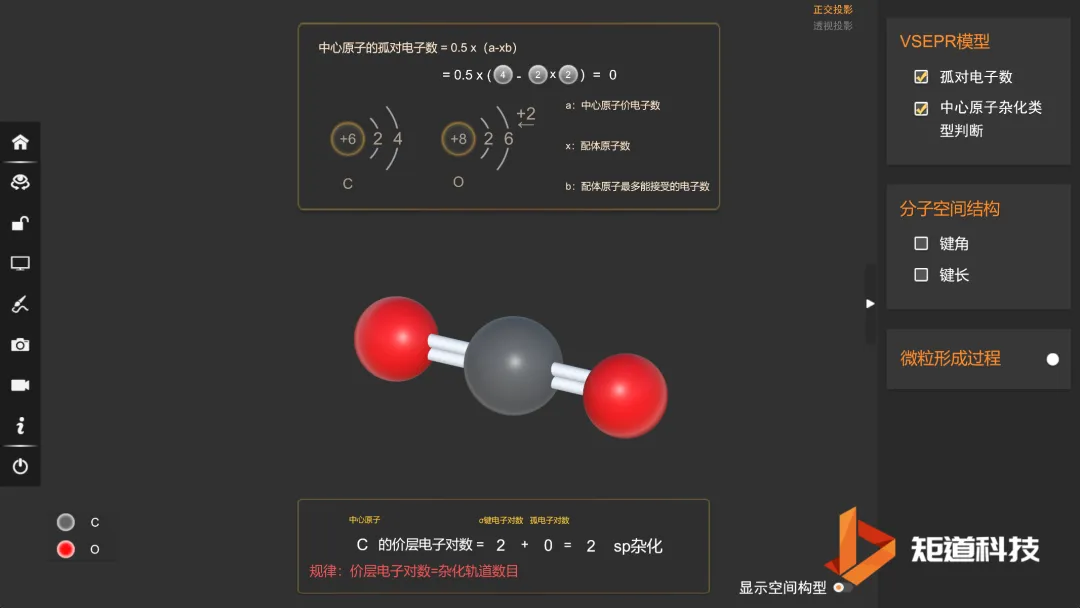
CO₂的价电子对数为2
为3时,取三角形;
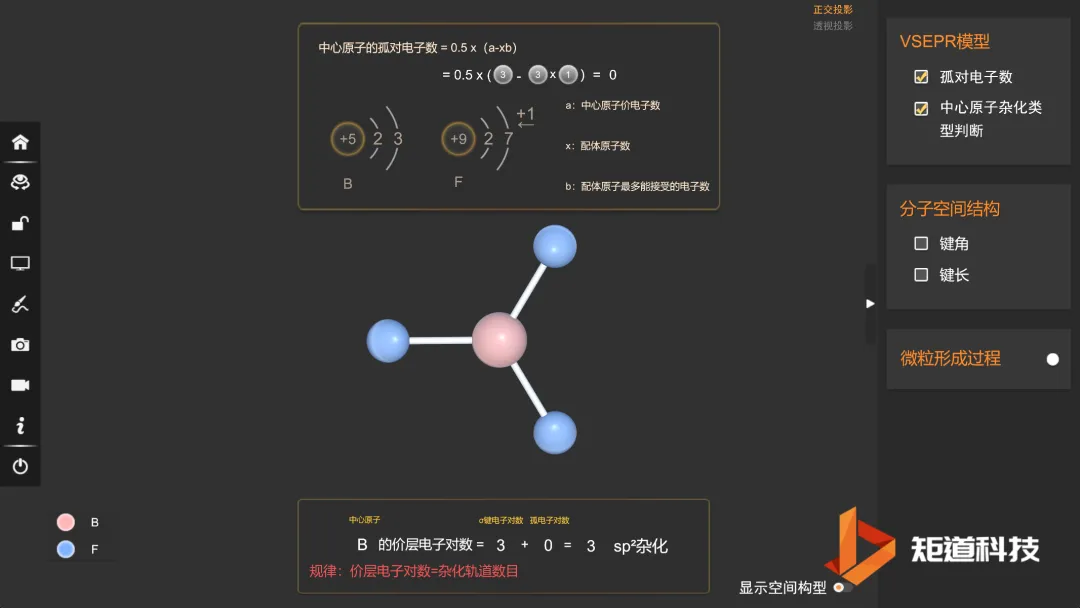
BF₃的价电子对数为3
为4时,取四面体形;
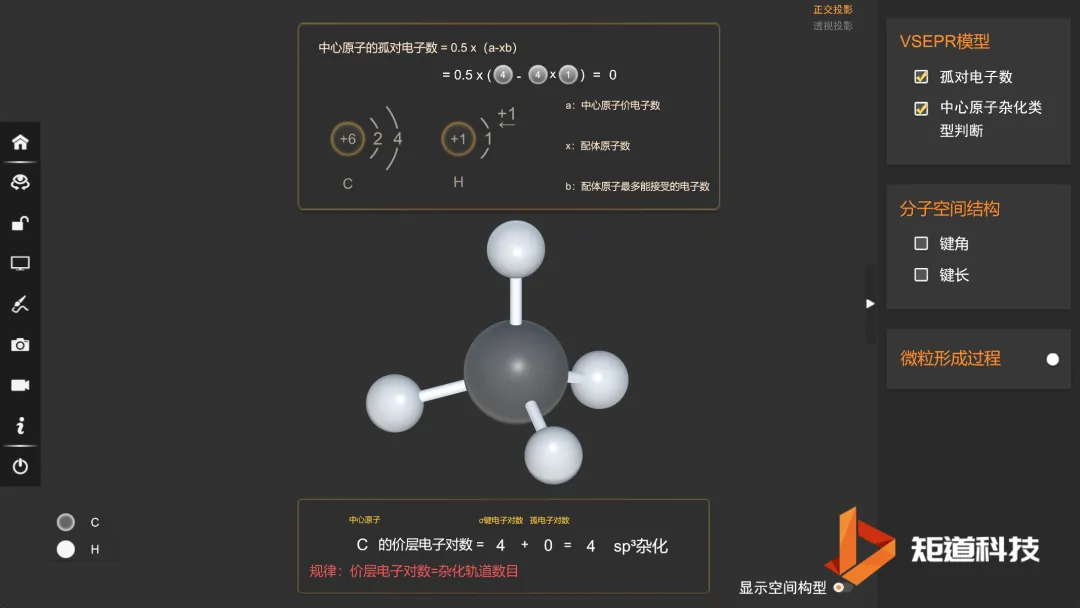
CH₄的价电子对数为4
为5时,取三角双锥形;为6时,取八面体形……
END
















