化学虚拟现实课堂
19世纪的化学家们通过氢和氯结合时会释放热量,认为原子之间有一种化学结合,他们把这种结合称为共价键。但在量子化学出现之前,没有化学家能解释为什么两个原子聚在一起形成稳定的共价键。
在量子力学中,用来描述分子成键性质的方法被称为分子轨道理论。在这个理论中,利用涉及单电子波函数的行列式来表示分子轨道。
我们探究原子结构是从单电子原子H开始的,同样,我们也从最简单的单电子分子H2+开始。
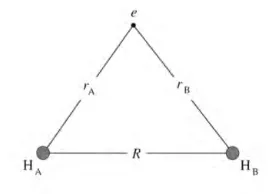
电子在H2+中受两个原子核的影响
通过解H2+的薛定谔方程,得到两个波函数ψ1和ψ2,以及相应的能量E1和E2。
其中,ψ1的能量比1s轨道能量低,当电子从氢原子的1s轨道进入ψ1时,体系的能量降低,ψ1为成键轨道。
相反,电子进入ψ2时,H2+的能量比原来的氢原子和氢离子能量高,ψ2为反键轨道。
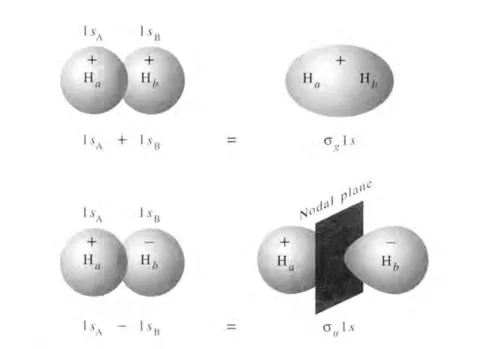
氢原子和氢离子的1s轨道叠加形成H2+的分子轨道图形
当原子相互靠近时,它们的原子轨道互相叠加,组合成分子轨道。当电子进入成键轨道时,体系能量降低,形成稳定的分子。此时原子间形成共价键。

氢原子和氢离子的1s轨道叠加形成H2+的成键轨道动态展示
从电子在分子中的分布情况,可了解共价键的成因。在之前的文章中,我们提到过电子可以看作是一团弥散在原子核周围的电子云,可由空间各点概率密度表示。我们可以用H2+中各点概率密度减去原子中电子云密度,得到下图。
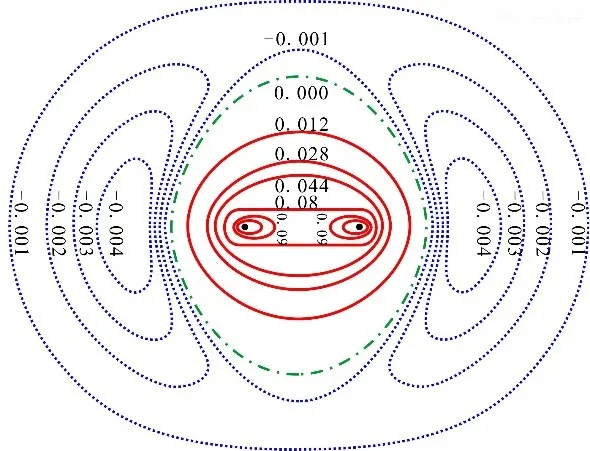
由图可见,成键轨道的作用实质上是将分子两端原子外侧的电子云概率抽调到2个原子核之间,增加了核间区域的电子云概率。聚集在核间的电子云,同时受到2个原子核的吸引,即核间的电子云把2个原子核结合在一起,这是H2+形成的原因。
从能量角度来看,聚集在核间运动的电子,同时受到两个原子核的正电荷吸引,这也有利于电子在核间聚集。
高中化学虚拟实验室「物质结构与性质」专题中丰富的VR虚拟现实教学资源,提供丰富的原子、分子、晶体结构与性质的微观原理与思维模型可视化情境,解决了实际教学中这部分知识专题「难教、难学、得分率低、可利用的教学素材少」的痛点。让老师轻松教、高效教,让学生喜欢学、自主学!
END
















