
化
学
键
概
念
什么是化学键?广义的说,化学键是将原子结合成物质世界的作用力。在物质世界里,原子互相吸引、互相排斥,以一定的次序和方式结合成分子或晶体。我们将原子间通过共用电子形成的化学键称为共价键。接下来我们借助矩道化学仿真实验室软件展示化学键的形成。

图1:H原子的1s轨道

图2:Cl原子的3s与3p轨道
通常电负性相等或相近的非金属原子之间形成的化学键为共价键,比如由H,C,O,N,S和卤素等元素组成的化合物中,原子以共价键和另一个原子结合,例如H2、HCl、Cl2、N2、O2、CH4等。

那么 什么是价键理论呢?
原子互相接近时,各原子中未成对的电子通过相互配对形成共价键,这种形成化学键的理论叫价键理论,或电子配对理论。在形成共价键时,一个电子和另一个电子配对以后,就不能和其他原子的电子配对了,这就是共价键的饱和性。例如,H原子中1s轨道只有1个未成对电子,所以两个H原子之间可以形成一个共价键结合成H2分子,可以表示为H-H。
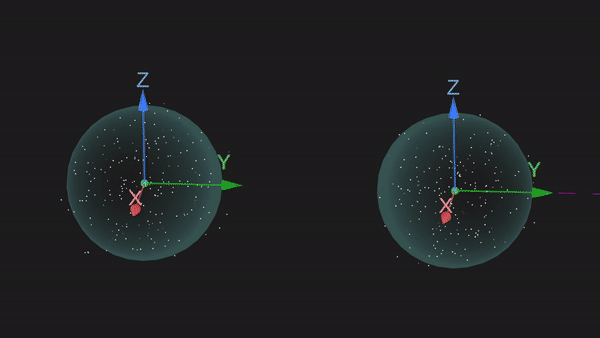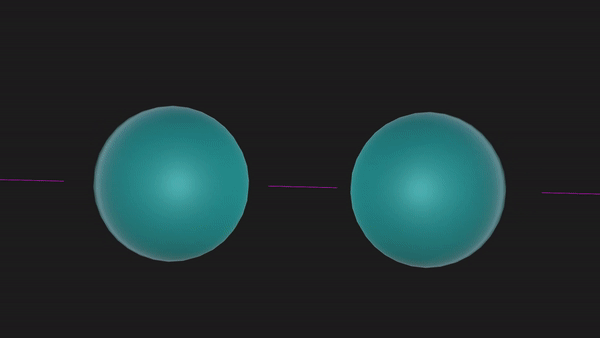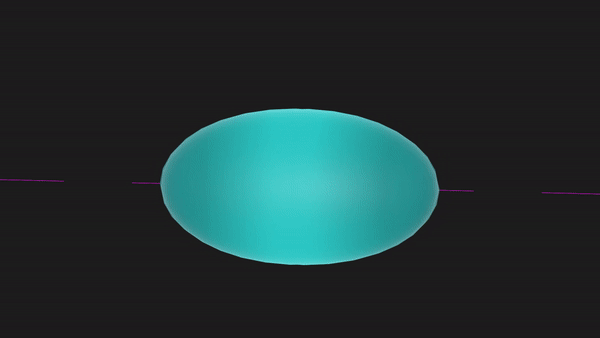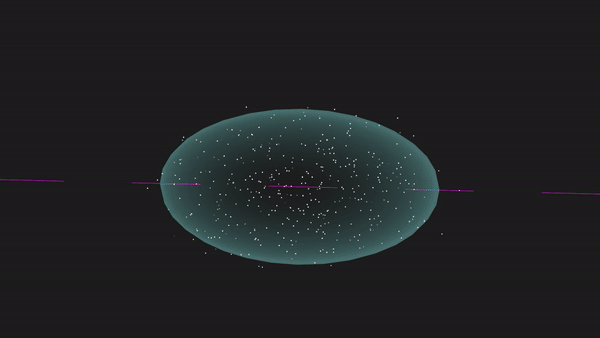
又比如,N原子中的三个2p轨道均有1个未成对电子,共有3个未成对电子,两个N原子之间便能够以共价三键的形式结合成N2分子,可以表示为N≡N。
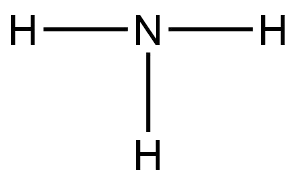
一个N原子也可以与三个氢原子以三个共价单键的形式结合成NH3分子,表示为:
另一方面,在形成共价键时,原子轨道重叠的多,则形成的共价键越牢固,所以原子轨道的空间取向将影响共价键的方向。比如在Cl2中,Cl的一个3p轨道有一个未成对电子,两个Cl原子就要沿着这个2p轨道的轴线接近才能形成共价键。
σ键与π键
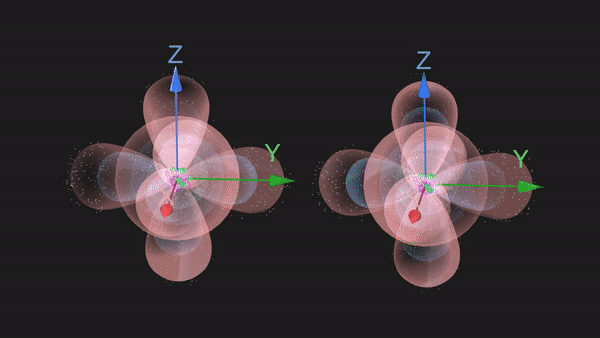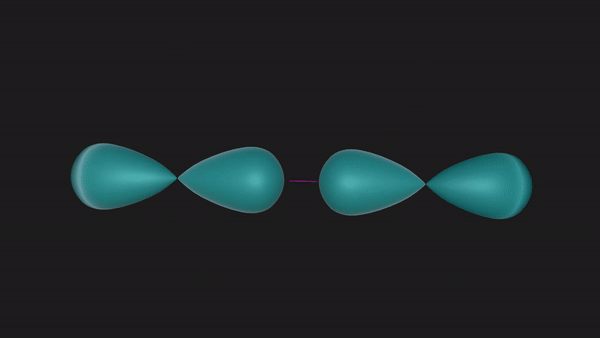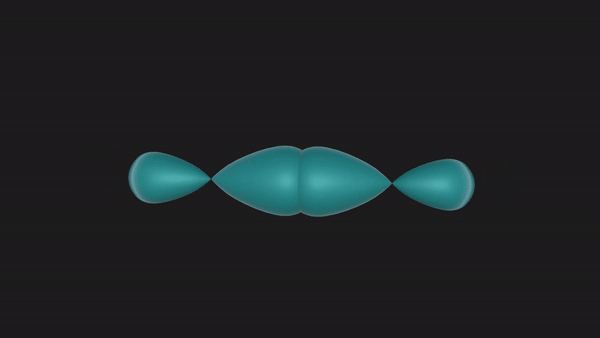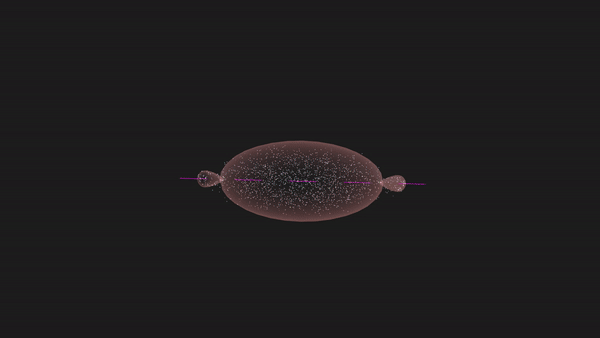
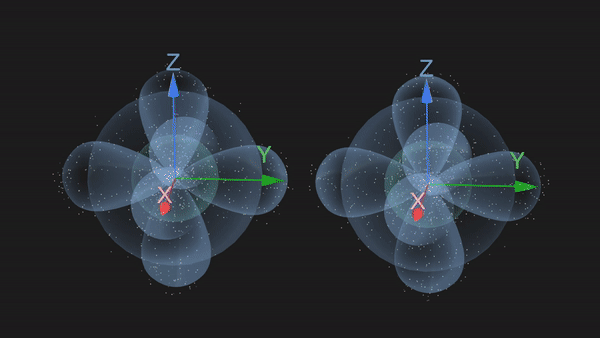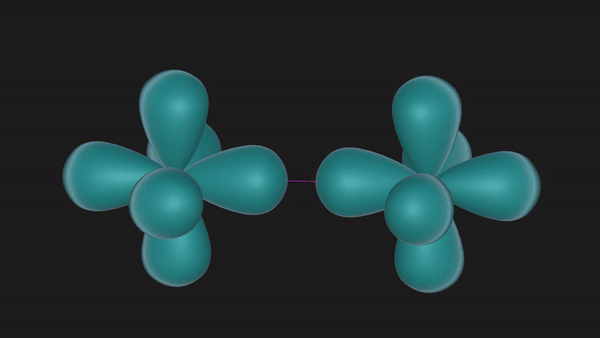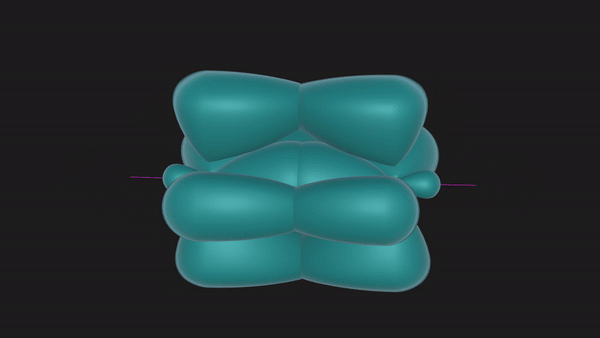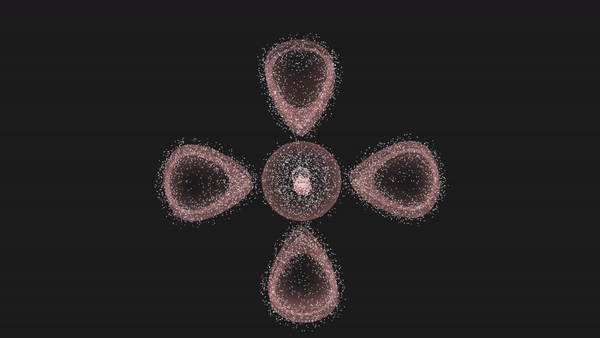
从3D结构示意图上可以看出来,N原子的价电子排布是2s22p3,其中2p轨道的三个电子将根据洪特规则,分别占据2px,2py,2pz三个原子轨道,是三个未成对电子。

当两个N原子沿着2px轨道的轴线相互接近时,2px轨道重叠形成一个共价键,同时它们的2py和2pz也会对应着两两重叠形成两个共价键,这样形成的共价键我们称之为共价三键。
从上述形成过程中可以发现,共价三键中的三个共价键并非是完全等同的。沿着轴线接近的2px轨道以“头碰头”的形式重叠时,垂直于轴线而相互平行的2py或者2pz轨道只能以“肩并肩”的方式重叠。

END


















