【矩道化学VR实验室】硫及其化合物

含硫物质多种多样,性质各不相同,而且它们在一定的条件下可以相互转化。通过氧化还原反应可以实现含不同价态硫元素的物质之间的转化;通过非氧化还原反应可以实现含有相同价态硫元素的不同物质之间的转化。
下面我们借助矩道化学仿真实验室一起来学习一下吧。
【性质总结】
(一)硫
1.物理性质:硫单质俗称硫磺,通常状态下它是一种淡黄色的固体,易溶于CS₂,难溶于水,微溶于酒精。
2.化学性质:
(1)氧化性:如2Na + S ≜ Na₂S
(2)还原性:如
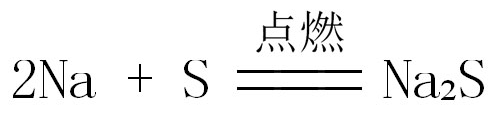
(二)硫化氢
1.物理性质:无色、有臭鸡蛋气味的气体,有剧毒,易溶于水其水溶液称为氢硫酸
2.化学性质——还原性:如2H₂S+SO₂=3S↓+2H₂O
(三)二氧化硫
1.物理性质:无色,有刺激性气味的有毒气体,密度比空气大,易溶于水。
2.化学性质
(1)酸性氧化物的通性:如SO₂ + H₂O = H₂SO₃
(2)氧化性:如2H₂S +SO₂ = 3S↓+ 2H₂O
(3)还原性:如SO₂ + Cl₂ + 2H₂O = H₂SO₄ + 2HCl
(4)漂白性。
(四)三氧化硫1.物理性质:温常压下是液体。2.化学性质:
(1)具有酸性氧化物的通性。
(2)既可被氧化,又可被还原。
(五)硫酸
1.稀硫酸——表现出酸的通性。
2.浓硫酸
(1)物理性质:纯H₂SO₄是无色油状液体,沸点高,难挥发,密度大于水,溶解于水时放出大量热。
(2)特性:
①吸水性(常用作干燥剂)
②脱水性。
(3)强氧化性:
①与金属的反应:如Cu + 2H₂SO₄ (浓) ≜ CuSO₄ + SO₂↑+ 2H₂O
②与非金属的反应:如C + 2H₂SO₄(浓)≜ CO₂↑+ 2SO₂↑+ 2H₂O
【转化规律】
(一)性质规律
处于最高价态的元素只有氧化性,处于最低价态的元素只有还原性,处于中间价态的元素既有氧化性,又有还原性。如果只从S元素考虑,H₂S只有还原性,H₂SO₄只有氧化性,S、SO₂、H₂SO₃既有氧化性,又有还原性。这些中间价态的硫元素遇到强还原剂时,表现氧化性;遇到强氧化剂时,表现还原性。如S与H₂反应时生成H₂S,与O₂反应时生成SO₂。
(二)价态归中规律
当高价态硫与低价态硫之间发生氧化还原反应时,一般遵循价态归中规律。如:
S + 2H₂SO₄(浓)≜ 3SO₂↑+ 2H₂O
2H₂S+ SO₂ = 3S↓ + 2H₂O
(三) 歧化规律
在一定的条件下,处于中间价态的硫能发生歧化反应。如:
3S + 6KOH ≜2K₂S + K₂SO₃ + 3H₂O
(四) 不交叉规律
在氧化还原反应中,以硫元素相邻价态之间的转化最容易;相邻价态的硫元素之间不发生氧化还原反应;硫元素的不同价态之间发生反应时,硫元素的化合价只靠近而不交叉。如:
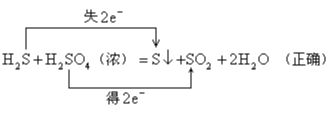
【小试牛刀】
请自选器材和药品,设计实验方案,要求:以硫单质为起点,经过反应最后又可得到硫单质。小明同学的实验方案如下,你能说出其他方案吗?
下面我们借助化学融合创新实验室来操作实验。