今天,我们一起走进矩道化学VR课堂,共同学习共价键的有关知识。
01
共价键
当一个原子的含有一个电子的原子轨道与另一个原子的含有一个电子的原子轨道重叠时,两个原子之间就形成了共价键。重叠区域的两个电子就是成键电子。
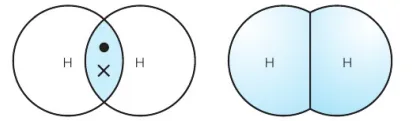
H2分子的共用电子对
它们有时被称为“共用电子对”。共价键是键合原子的两个原子核和它们之间共用的一对电子之间的静电吸引力。
接下来,我们借助矩道化学VR实验室,研究不同分子的共价键。
02
H2分子
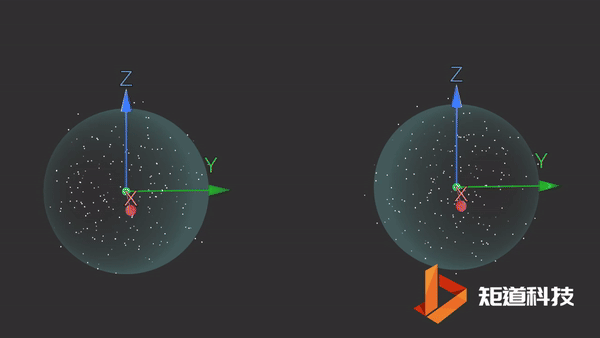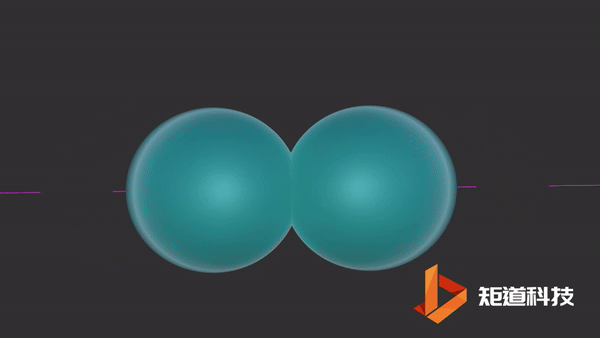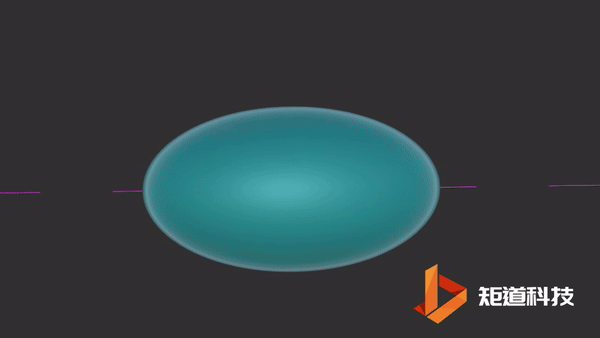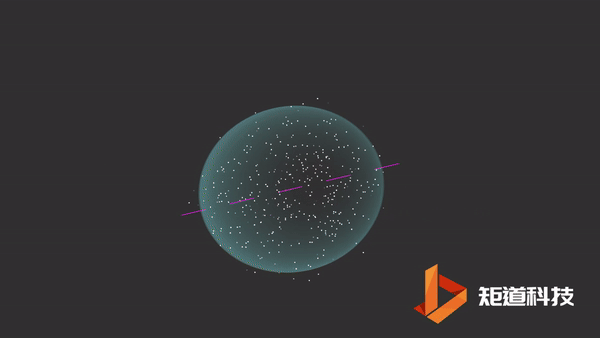
氢原子的电子排布是1s1。当两个氢原子结合形成一个氢分子时,两个s轨道重叠形成一个新的分子轨道。原本的两个电子就存在于这个新轨道中。
03
Cl2分子
氯原子的电子排布是1s22s22p63s23p5,有一个p轨道中只有一个电子。
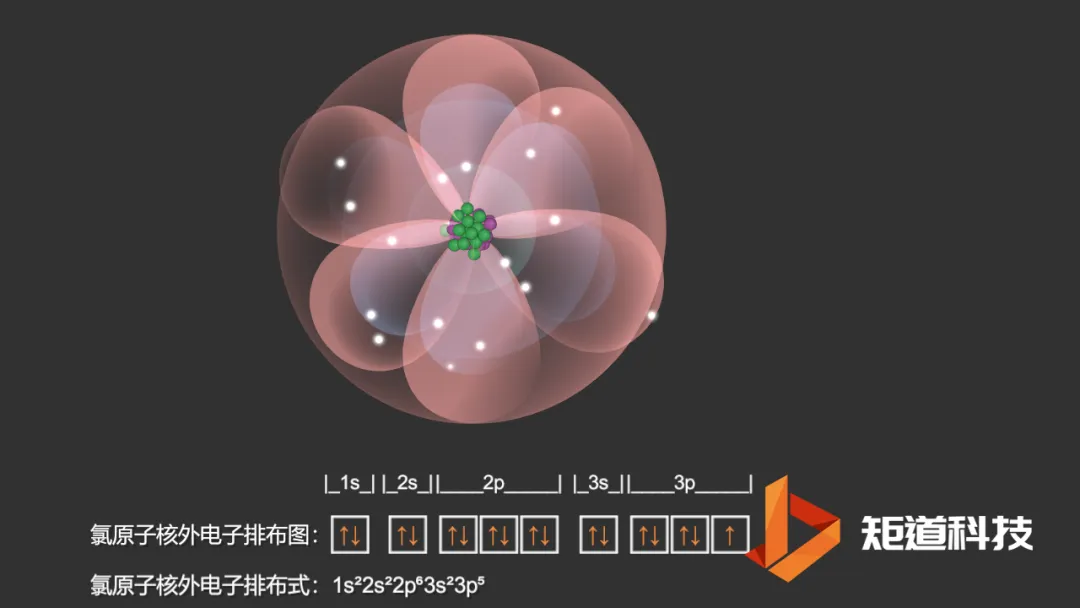
Cl原子的电子排布式
当两个氯原子结合在一起时,两个p轨道(每个包含一个电子)重叠。
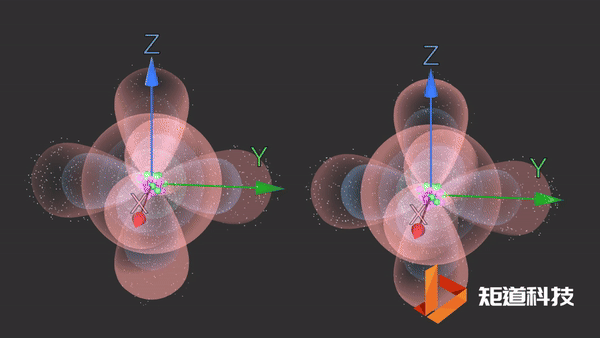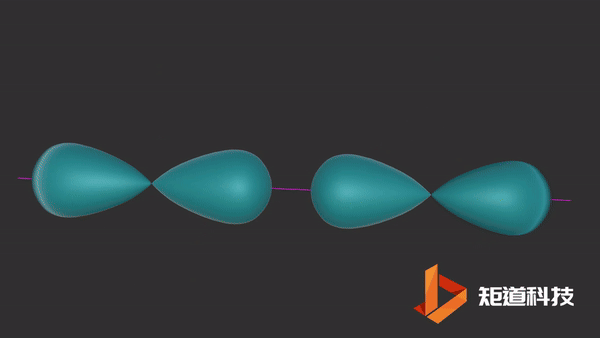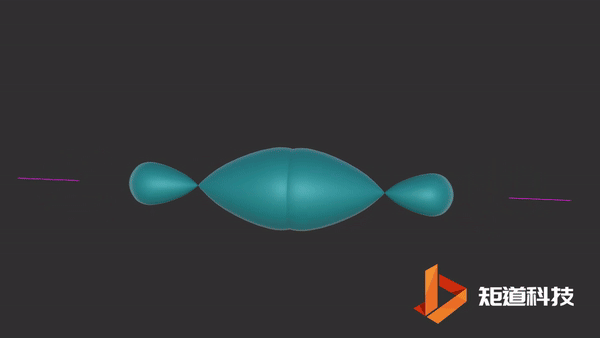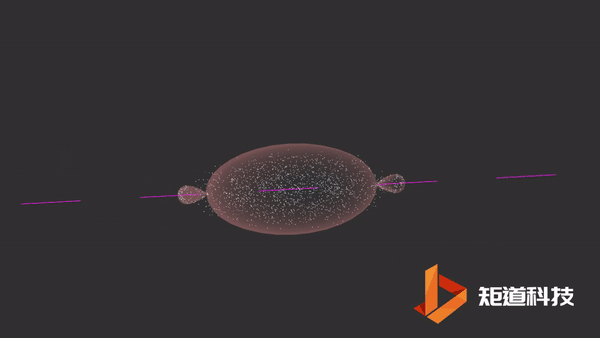
04
HCl分子
当氢原子的1s轨道和氯原子的一个p轨道重叠时,形成氯化氢分子。

N原子的电子排布式
像上面这些沿着轨道对称轴方向重叠的轨道导致σ (sigma)键的形成,在两个原子之间产生一个单键。
05
π键的形成
一旦σ键形成,在某些情况下,就有可能形成π键。
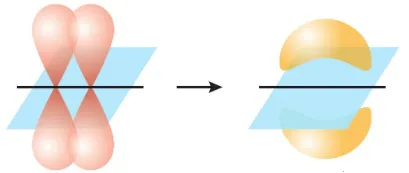
平行的p轨道重叠后形成π键。
氮分子(N2)的三键由一个σ键和两个π键组成。
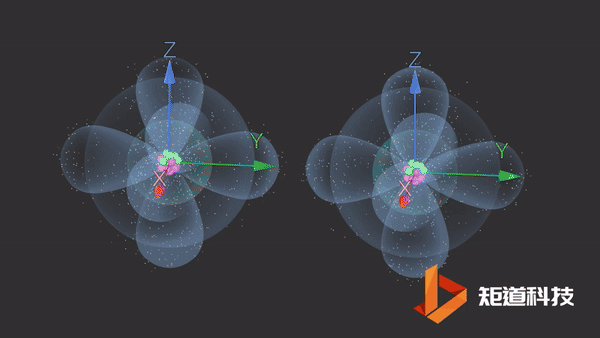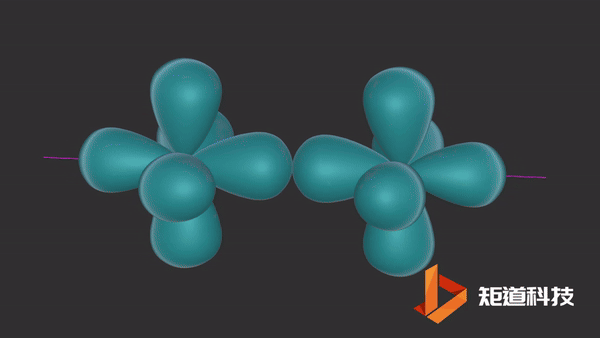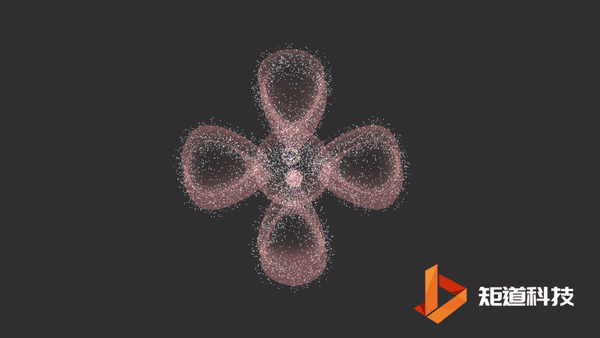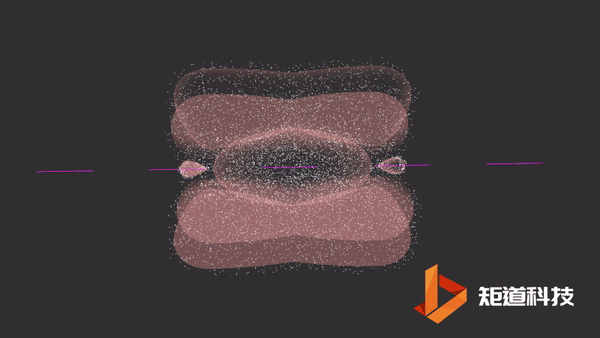
π键的一个特点是在σ键形成之前它不能形成。因此,π键只存在于由双键或三键连接的原子之间。
















