矩道化学虚拟仿真实验室,将常规教学中难以观察的原子的空间微观可视化,抽象晦涩的化学概念原理模型化、过程化。
在绝大多数情况下,分子都是由多个原子组成的。这些原子可以通过化学键连接在一起,一个原子可和一个或多个原子成键,也可由多个原子共同组成化学键。
因此,分子的结构可以从两个方面来描述:分子的几何结构和分子的电子结构。
结构比较简单的分子,比如非金属单质,可以归纳出如下的几点特征:
(1)非金属单质的成键规律,一般可按参与成键的价电子数及有关的原子轨道来分析。
周期表中第NA族非金属元素,每个原子可以提供8-N个价电子,与邻近的原子形成8-N个共价单键。因此在第NA族非金属单质中,与每个原子邻接的原子数一般为8-N,称为8-N规则。
例如卤族元素价电子数为1,形成双原子分子;
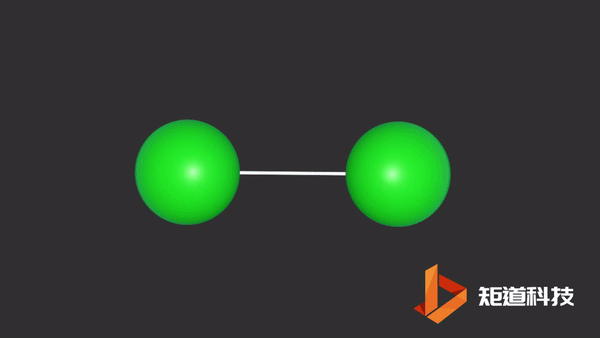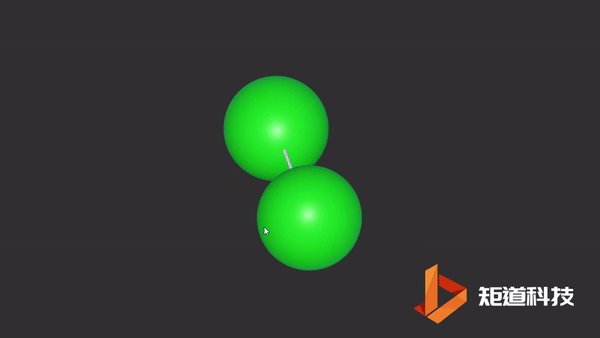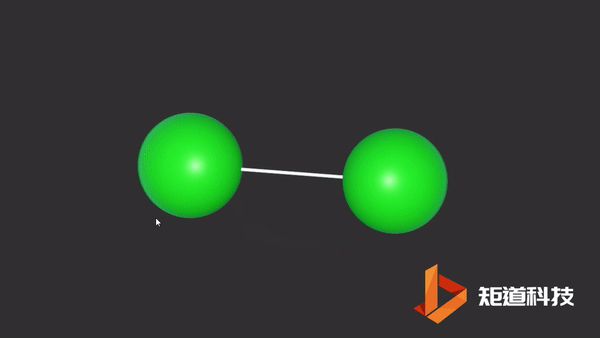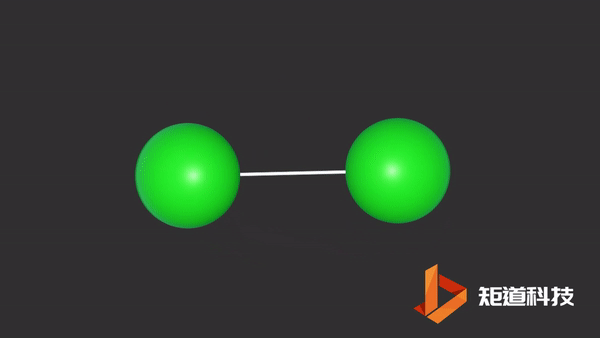
P、As、Sb等为3,则形成三配位的分子;
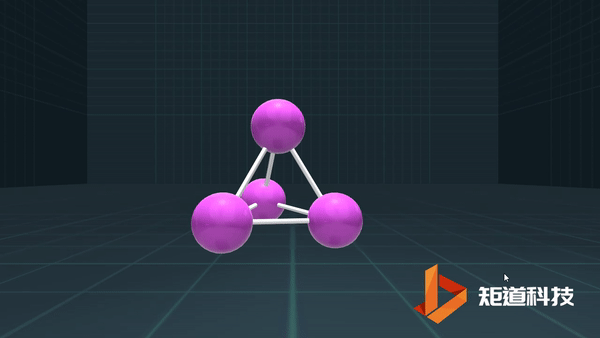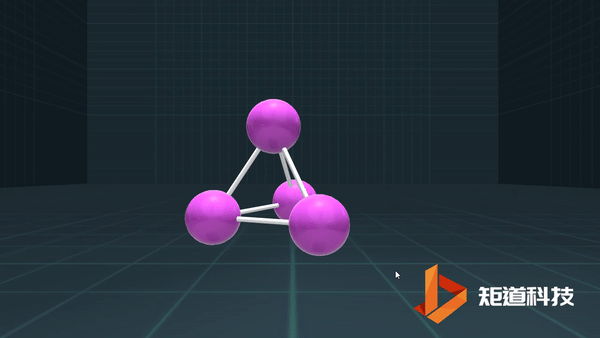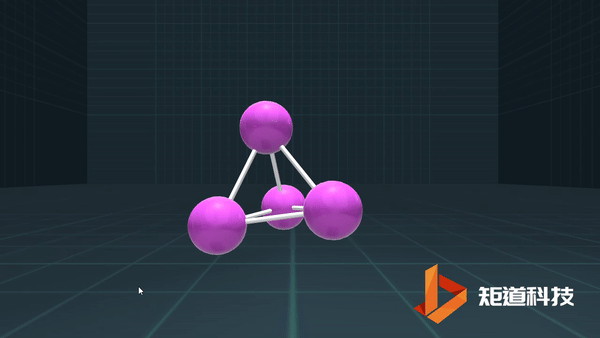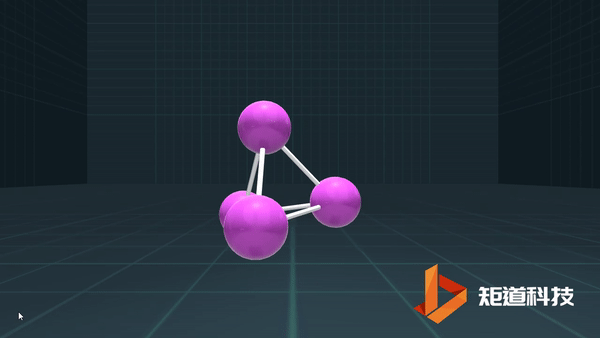
C、Si、Ge、Sn,则形成四配位的金刚石型结构等。

在单质结构中,有的形成π键、多中心键或有d轨道参与成键,此时键型发生变化,8-N规则体现在:N₂分子中共价键为三键;
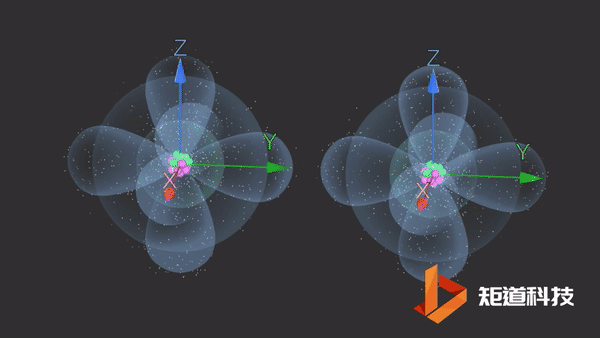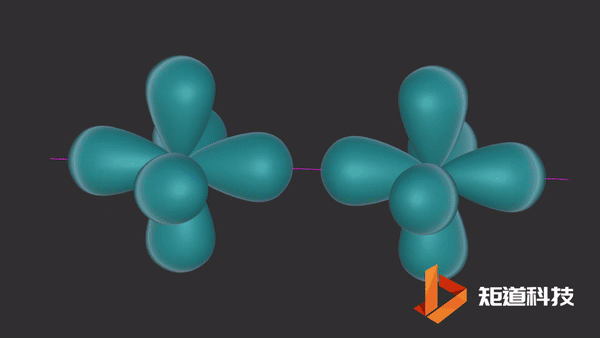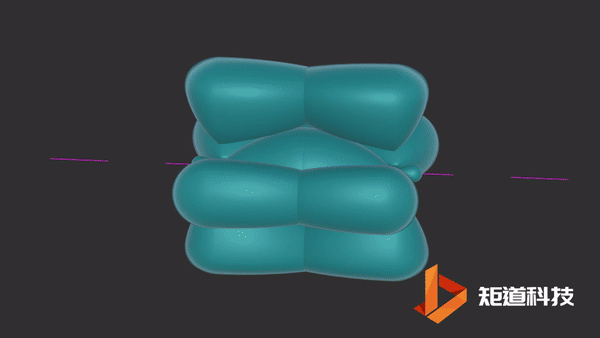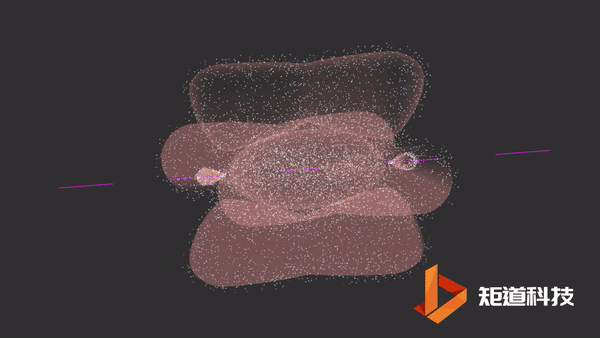
石墨的结构中存在离域π键。

(2)在非金属的单质结构中,同一族元素的金属性随着原子序数的递增而递增,分子间的界限也会越来越模糊,例如P、As、Sb、Bi及Cl₂、Br₂、I₂的结构数据,都说明分子间的最短接触距离与分子内键长的比值随着原子序数的增加而缩小。
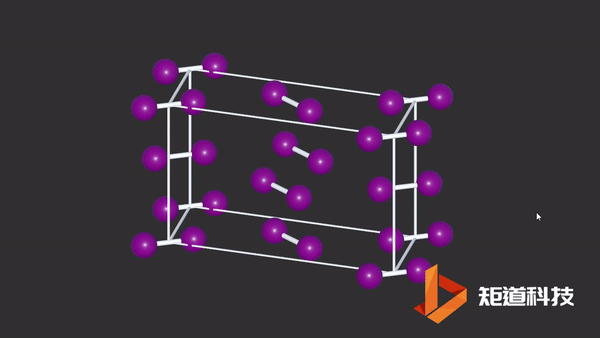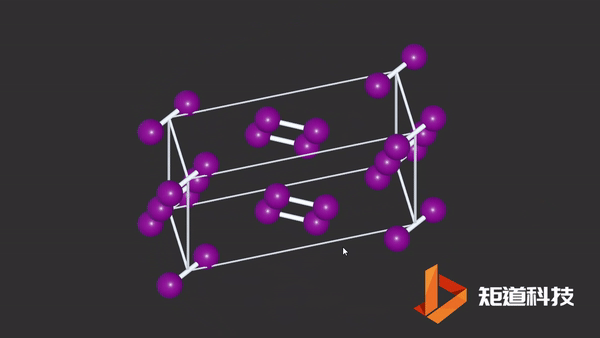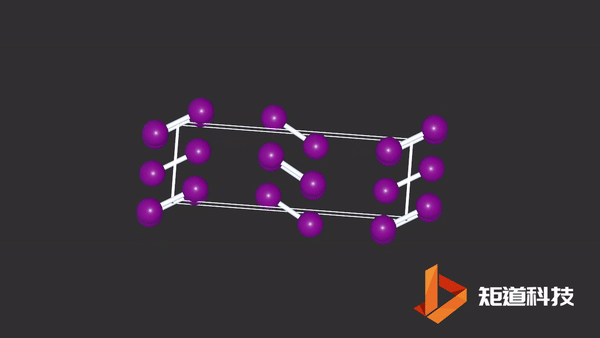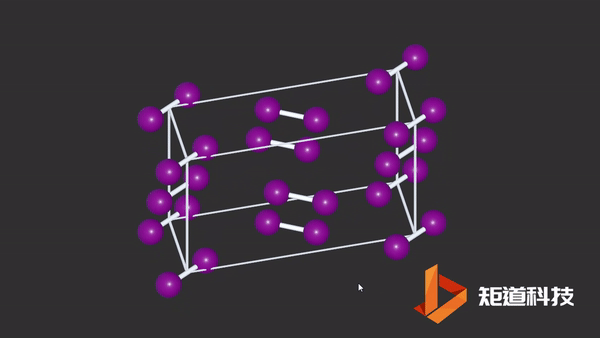
I2晶胞中碘原子与分子外的碘原子距离接近分子内间距
而在金属结构中,是分不出分子内和分子外的区别的。
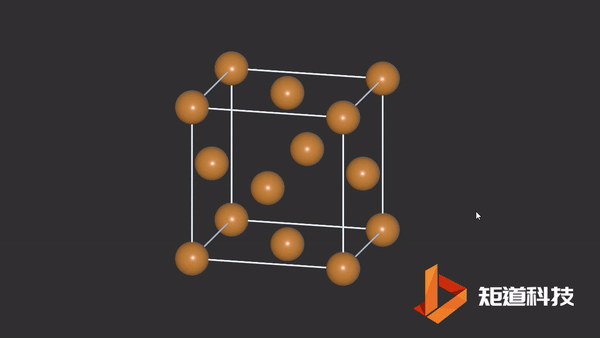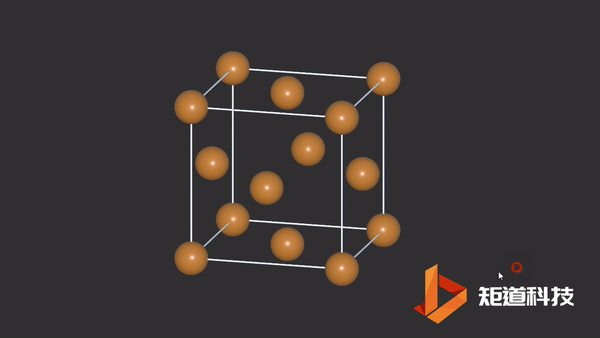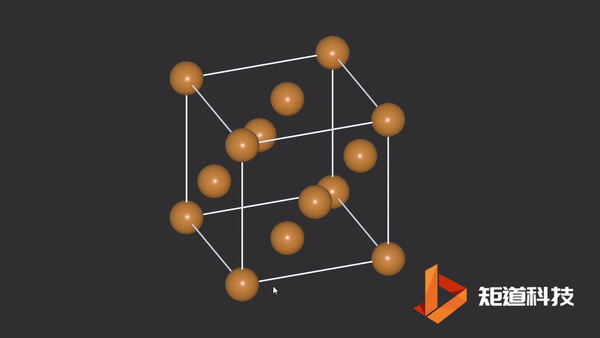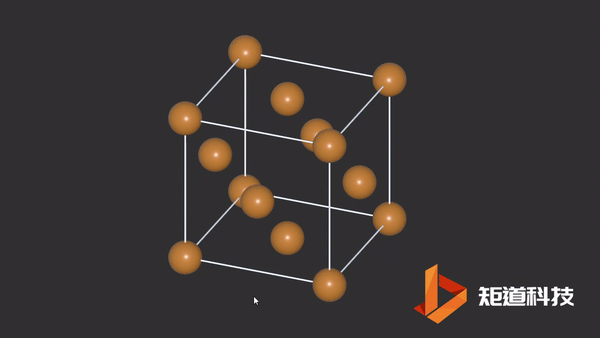
(3)对于P₄、C₆₀等具有封闭凸多面体的分子、凸多面体的面数(F)、棱数(E)和顶点数(V)之间的关系符合几何中的Euler公式:
F+V-E=2
例如,P₄作为四面体有4个面、6条棱和4个顶点,4+4-6=2;
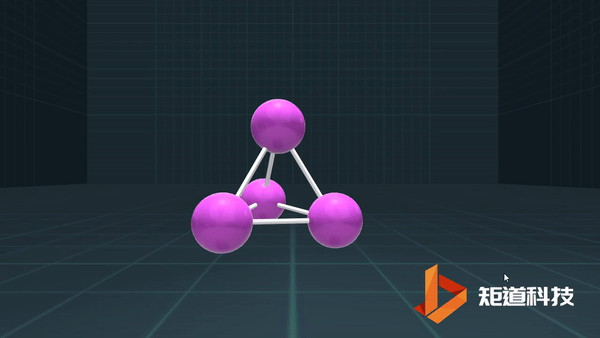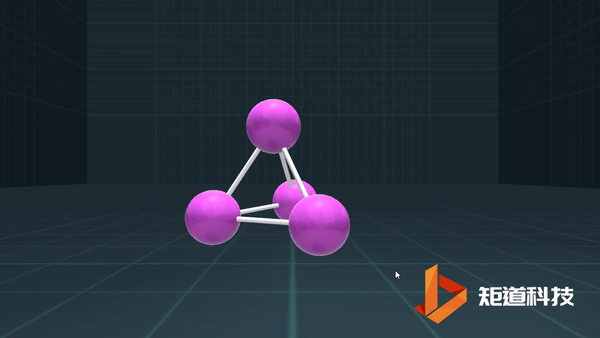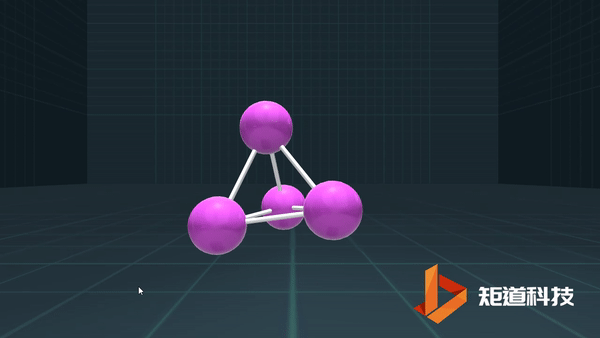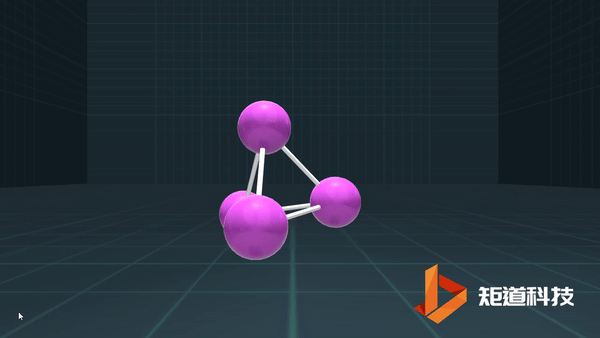
B₁₂作为正二十面体有20个面、30条棱和12个顶点,20+12-30=2;
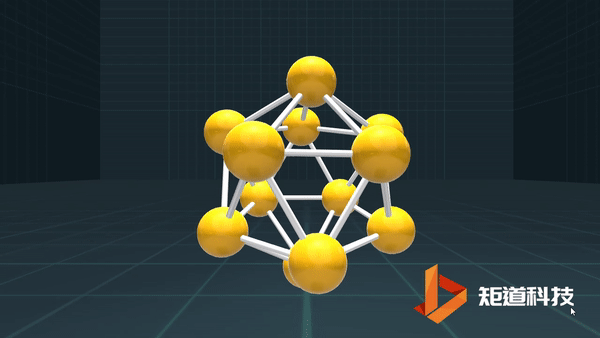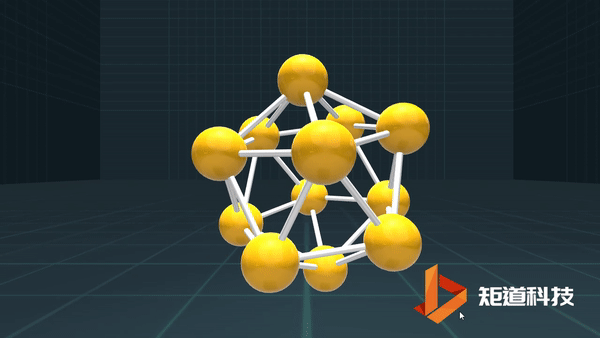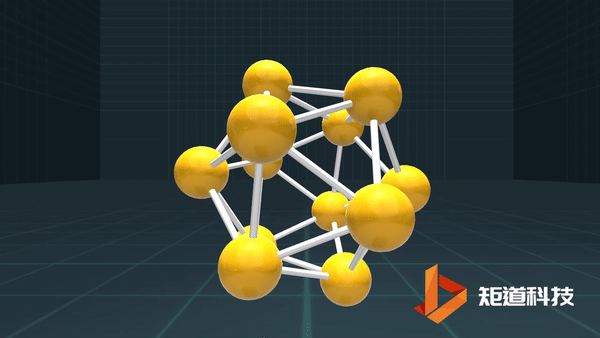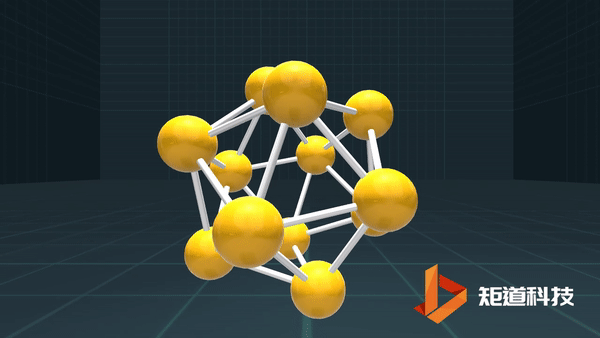
足球烯C₆₀有32个面、90条棱和60个顶点,32+60-90=2。

虚拟现实技术作为新兴的技术形态,与学科教学融合创新,是智慧校园建设和学校数字化教育变革的新力量。化学课堂中,综合应用化学VR/3D虚拟仿真实验室有助于探索立足教学、深入课堂,构建以校为本、应用驱动、注重创新、精准测评的化学教学新生态。
END
















