【矩道生物虚拟实验室】生物课堂重难点一点通—血球计数板全方位解析
更新时间:2022-05-04 来源:矩道科技 浏览:0
生物是一门注重逻辑思维的学科,生物概念、生物规律、科学探究方法、科学思维等内容之间有着紧密地联系,现有的按课时进行的教学将这些联系不断削弱,逐渐形成一个个碎片化的知识。矩道高中生物VR/3D虚拟仿真实验室的设计过程中用整合的理念和整体的构思来挖掘生物教学内容内在的体系。
生物教学中,通过矩道生物仿真实验室中的各类生物仿真实验以及器材类、动画类等虚拟仿真资源创设整体性生物课程资源,可以实现高效能的“教与学”,更好地贯彻生命观念,助推生物学科核心素养的养成。

生物仿真实验-培养液中酵母菌种群数量的动态变化
《培养液中酵母菌种群数量的动态变化》是新教材“选择性必修2-生物与环境”中重要的的学生分组实验,在该实验中,需要测定酵母菌细胞数量。测定细胞数目的方法有显微镜直接计数法、平板菌落计数法、光电比浊法等,教材采用的是较为简便、快速、直观的显微镜直接计数法。

常用的测定细胞数目的方法
因此,学会使用血球计数板进行准确计数,是该实验成功与否的关键,也是教学与考试中的难点和易错点。
一、血球计数板的使用原理
显微镜直接计数法是将小量待测样品的悬浮液置于一种特别的具有确定面积和容积的载玻片上(又称计菌器),于显微镜下直接计数,然后推算出含菌数的一种方法。血球计数板是常用的计菌器之一。
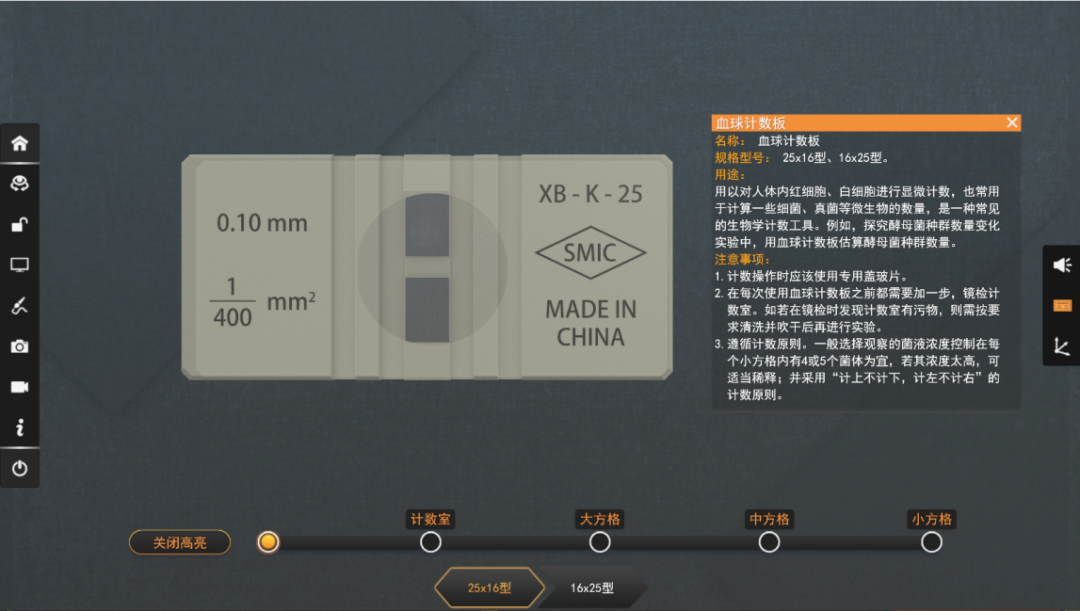
血球计数板
血球计数板是一种专门用于计算较大单细胞微生物的一种仪器,由一块比普通载玻片厚的特制玻片制成的玻片中有四条下凹的槽,构成三个平台。中间的平台较宽,其中间又被一短横槽隔为两半,每半边上面刻有一个方格网。方格网上刻有9个大方格,其中只有中间的一个大方格为计数室。这一大方格的长和宽各为1mm,深度为0.1mm,其容积为0.1mm3,即1mm×1mm×0.1mm方格的计数板;大方格的长和宽各2mm,深度为0.1mm,其容积为0.4mm3,即2mm×2mm×0.1mm方格的计数板。在血球计数板上,刻有一些符号和数字,其含义是:XB-K-25为计数板的型号和规格,表示此计数板分25个中格;0.1mm为盖上盖玻片后计数室的高;1/400mm2表示计数室面积是1mm2,分400个小格,每小格面积是1/400 mm2。
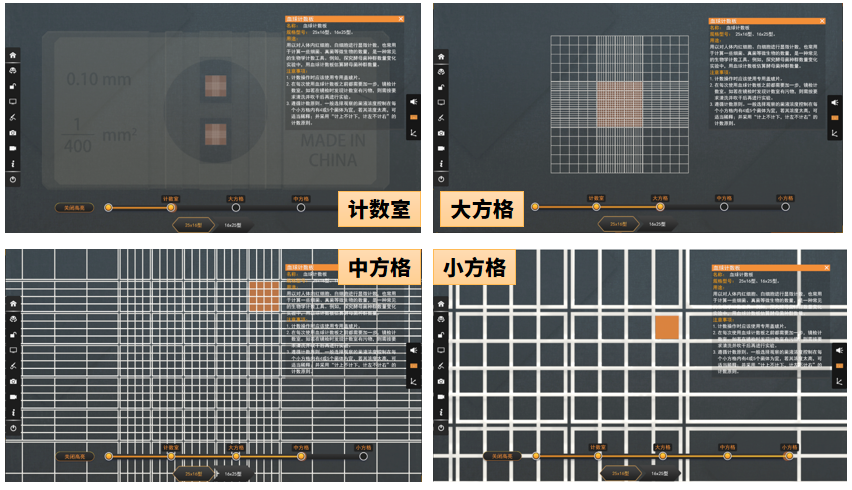
血球计数板 - 计数室层级
计数室通常也有两种规格:一种是16×25型,即大方格内分为16中格,每一中格又分为25小格;另一种是25×16型,即大方格内分为25中格,每一中格又分为16小格。但是不管计数室是哪一种构造,它们都有一个共同的特点,即每一大方格都是由16×25=25×16=400个小方格组成。
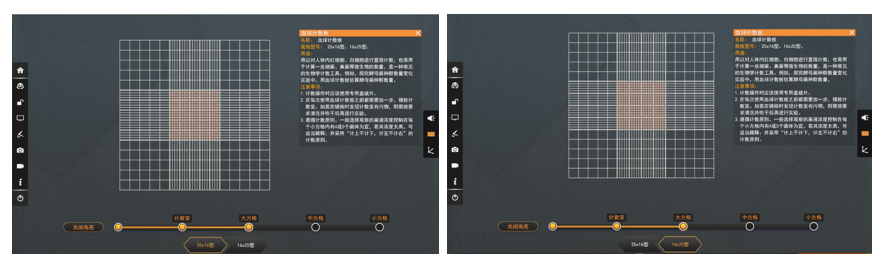
血球计数板 - 计数室类型
1.25×16型的计数板
中央大方格以双线等分成25个中方格,每个中方格又分成16个小方格,供细胞计数用(见图三)。一般计数四个角和中央的五个中方格(80个小方格)的细胞数。计数重复3次,取其平均值。计数完毕后,依下列公式计算:
酵母细胞个数/1mL=80个小方格细胞总数/ 80 ×400×10000×稀释倍数
2.16×25型的计数板
将计数室放大,可见它含16中格,一般取四角:1、4、13、16四个中方格(100个小方格)计数。将每一中格放大,可见25个小格。计数重复3次,取其平均值。计数完毕后,依下列公式计算:
酵母细胞个数/1mL=100个小方格细胞总数/ 100 ×400×10000×稀释倍数
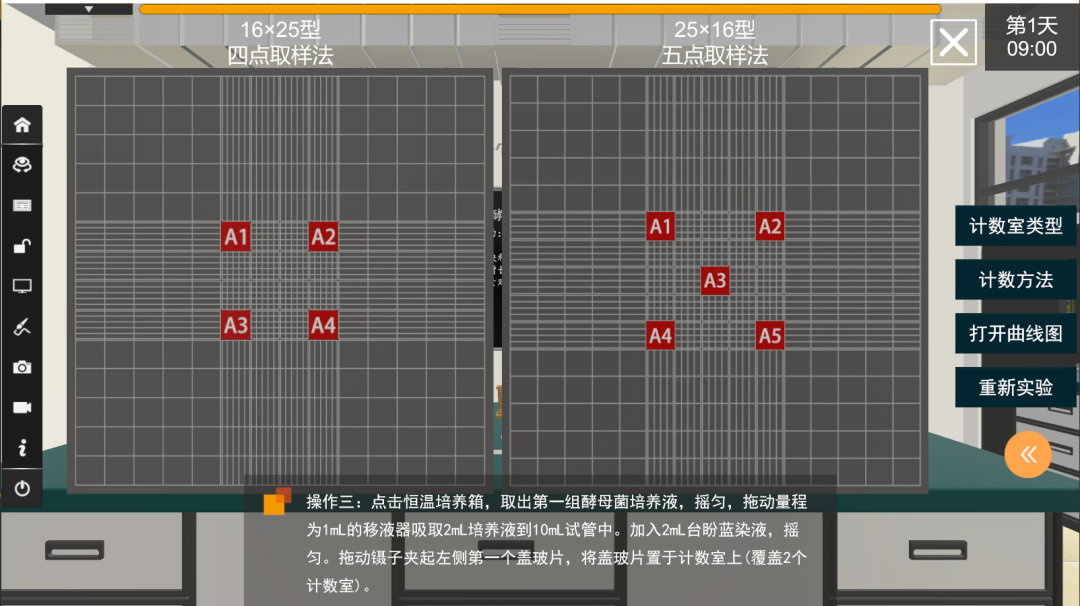
血球计数板 - 不同计数室类型的取样方法
二、血球计数板的使用方法步骤
使用血球计数板计数时,按照如下的实验步骤进行:
1.镜检计数室。在加样前,先对计数板的计数室进行镜检。若有污物,则需清洗,吹干后才能进行计数;
2.加样品。将清洁干燥的血球计数板的计数室上加盖专用的盖玻片,用吸管吸取稀释后的酵母菌悬液,滴于盖玻片边缘,让培养液自行缓缓渗入,一次性充满计数室,防止产生气泡,充入细胞悬液的量以不超过计数室台面与盖玻片之间的矩形边缘为宜。多余培养液可用滤纸吸去;

血球计数板的使用 - 加样品
3.计数。稍待片刻(约5min),待酵母菌细胞全部沉降到计数室底部后,将计数板放在载物台的中央,先在低倍镜下找到计数室所在位置后,再转换高倍镜观察、计数并记录。
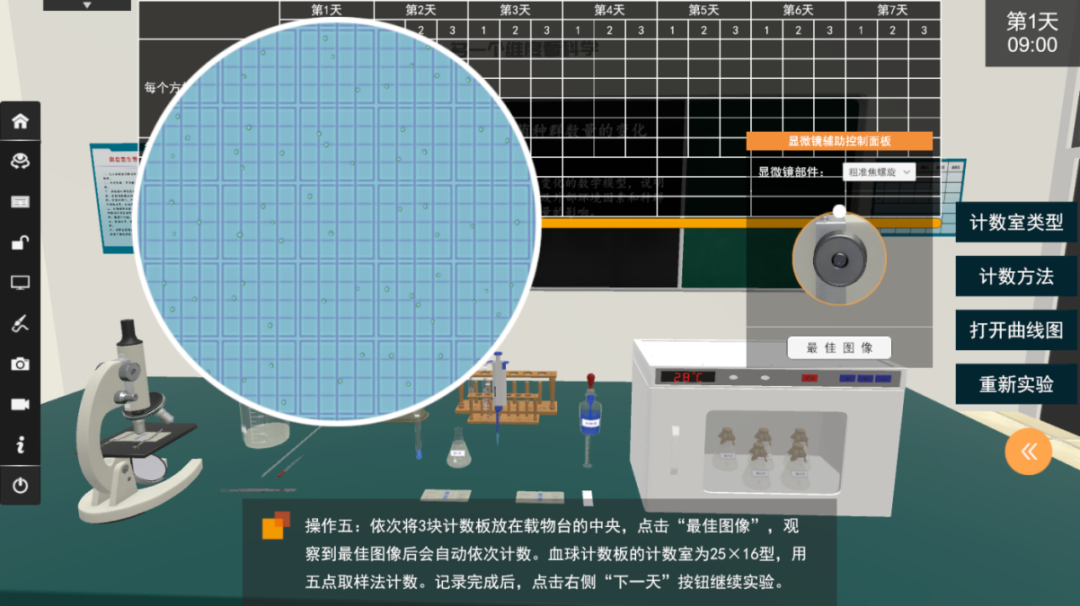
血球计数板的使用 - 观察与计数
三、血球计数板的使用注意事项
《培养液中酵母菌种群数量的动态变化》实验是一个历时较长(7天左右)的实验,事前一定要做好周密的计划,定程序、定时间、定人员。每天采用抽样检测法使用血球计数板对酵母菌进行计数,在计数时应从以下几方面注意。
1.每天同一时间,各组取出本组的试管,用血球计数板计数酵母菌个数,并作记录,连续观察7天。该实验通过探究培养液中酵母菌种群数量的变化,尝试建构种群增长的数学模型并用数学模型解释种群数量的变化,说明制约种群个体数量变化的种群外部环境因素和种群内部因素。
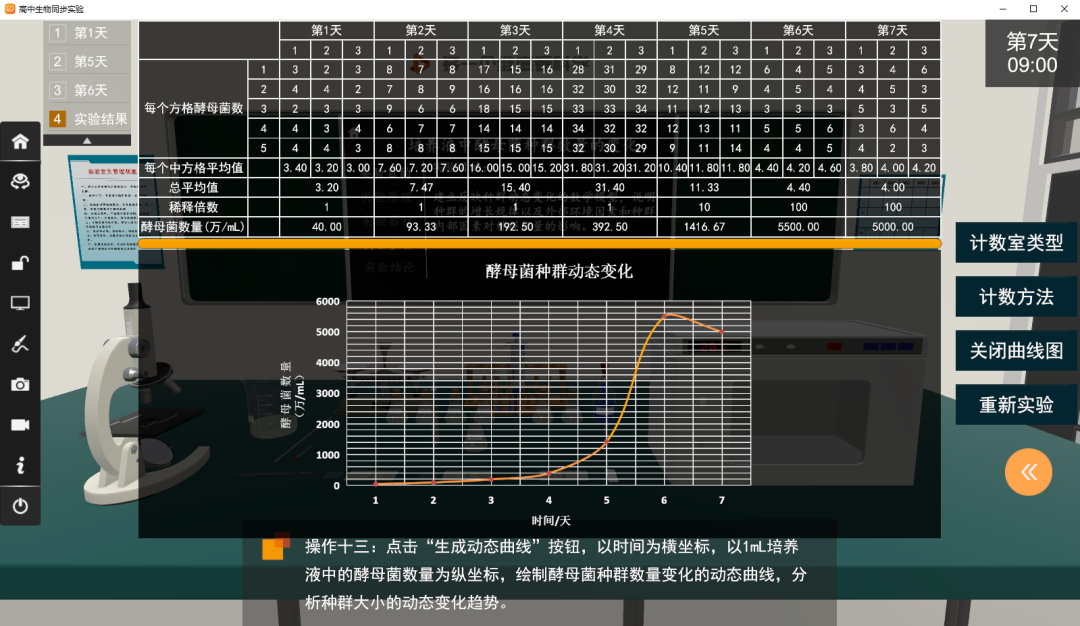
酵母菌群数量的变化数学模型
2.从试管中吸出培养液进行计数之前,要将试管轻轻震荡几下,这样使酵母菌分布均匀,防止酵母凝聚沉淀,提高计数的代表性和准确性,求得的培养液中的酵母菌数量误差小。
3.如果一个小方格内酵母菌过多,难以数清,应当对培养液进行稀释以便于酵母菌的计数。具体方法是:摇匀试管,取1mL酵母菌培养液,加入成倍的无菌水稀释,稀释n倍后,再用血球计数板计数,所得数值乘以稀释倍数。以每小方格内含有4—5个酵母细胞为宜。特别是在培养后期的样液需要稀释后计数。
4.活酵母有芽殖现象,若芽体达到母细胞大小的一半时,即可作为两个菌体计数,若芽体小于母细胞一半时为1个酵母细胞。
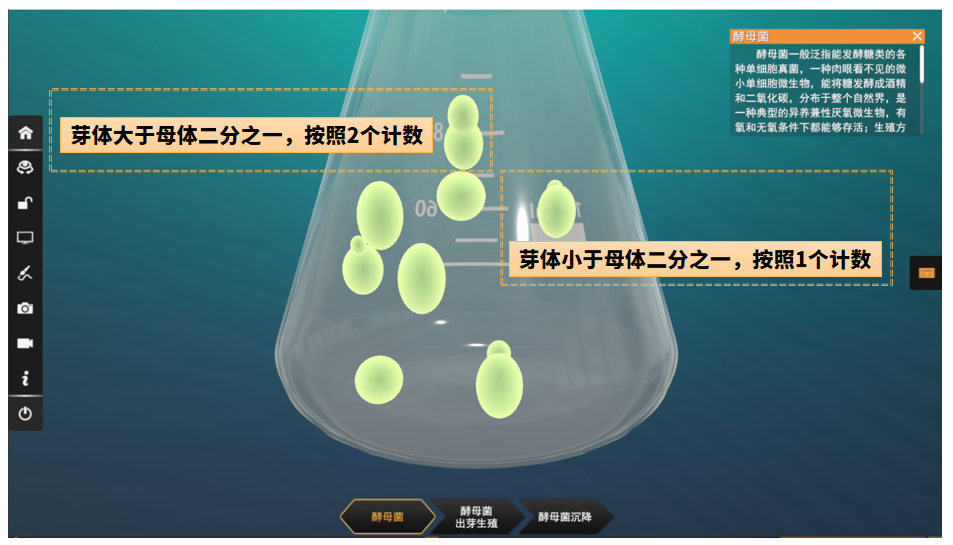
培养液中酵母菌 - 计数原则
5.对于压在方格界线上的酵母菌应当计数同侧相邻两边上的菌体数,一般可采取“数上线不数下线,数左线不数右线”的原则处理,另两边不计数。计数时,如果使用16格×25格规格的计数室,要按对角线位,取左上、右上、左下、右下4个中格(即100个小格)的酵母菌数;如果规格为25格×16格的计数板,除了取其4个对角方位外,还需再数中央的一个中格(即80个小方格)的酵母菌数。
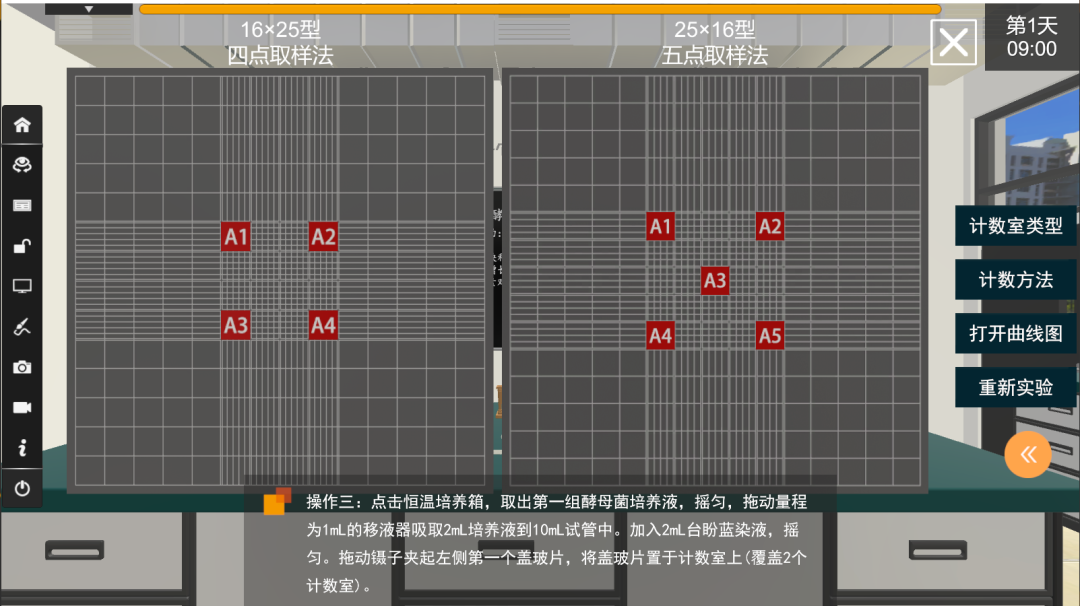
不同型号血球计数板 - 计数方格
6.计数一个样品要从两个计数室中计得的平均数值来计算,对每个样品可计数三次,再取其平均值。计数时应不时调节焦距,才能观察到不同深度的菌体。按公式计算每1ml(或10mL)菌液中所含的酵母菌个数。
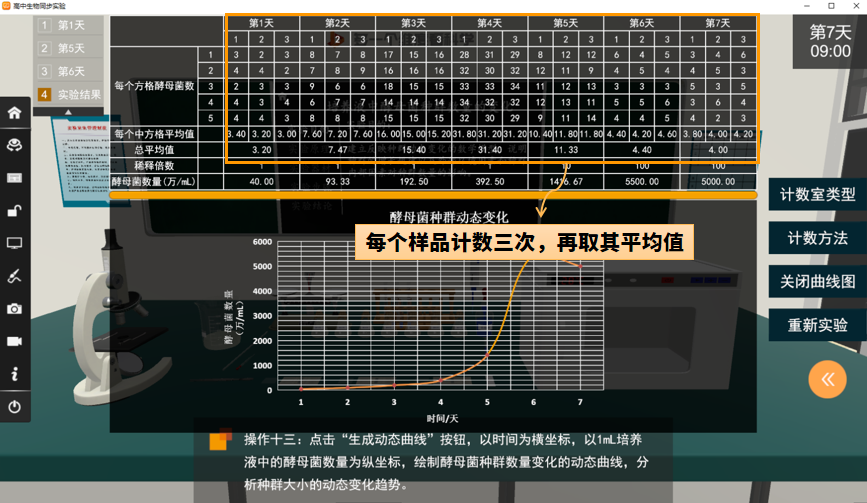
生物仿真实验-样品设置重复,取平均值
7.血球计数板的清洁
血球计数板使用后,用自来水冲洗,切勿用硬物洗刷,洗后自行晾干或用吹风机吹干,或用95%的乙醇、无水乙醇、丙酮等有机溶剂脱水使其干燥。通过镜检观察每小格内是否残留菌体或其他沉淀物。若不干净,则必须重复清洗直到干净为止。
















